Структурно карбоновые кислоты являются важными органическими соединениями, ацильными производными. Они являются своего рода строительным материалом для многих производных, в том числе сложных эфиров и амидов. В природе встречается целый ряд различных карбоновых кислот, таких как уксусная кислота CH3COOH, являющаяся основным соединением столового уксуса, масляная кислота CH3CH2CH2COOH, отвечающая за запах прогорклого масла, или более сложная холевая кислота, являющаяся основным компонентом желчной кислоты человека.

Общая формула карбоновых кислот:
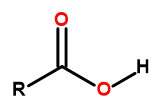
Рисунок 1 Общая формула карбоновых кислот.
Номенклатура карбоновых кислот
В соответствии с международной номенклатурой ИЮПАК, карбоновые кислоты могут быть названы двумя способами в зависимости от размера и сложности молекулы. Кислотам, являющимся алифатическими производными, присваиваются системные названия путем замены окончание алкана с «-ан» на «-овая» и добавляя слово «кислота», например, пропановая кислота, бутановая кислота, 3-этил-6-метилоктандиовая кислота. Нумерация атомов углерода в таких химических соединениях всегда начинается с атома, находящегося в функциональной группе – COOH. Вторая система номенклатуры, полезная особенно в отношении кислот, в которых карбоксильная группа присоединена к кольцу, допускает добавление к систематическому названию системы слов «кислота» и «карбоновая». В таких случаях нумерация атомов углерода начинается с атома, к которому присоединена карбоксильная группа, которая сама рассматривается в качестве заместителя.
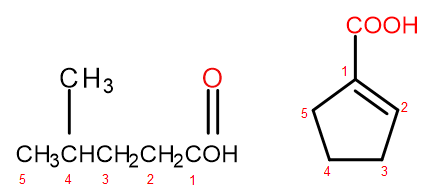
Рисунок 2 Нумерация атомов углерода слева направо: 4-метилпентановая кислота, 1-циклопентенкарбоновая кислота.
Учитывая исторический фактор, а именно то, что карбоновые кислоты были одними из первых выделенных, очищенных и охарактеризованных органических соединений, система ИЮПАК также допускает множество общих названий как органических соединений, так и их ацильных групп.
Таблица 1 Избранные примеры общеупотребительных названий карбоновых кислот и их ацильных групп.
| Карбоновая кислота | Ацильная группа | ||
| Формула | Название | Формула | Название |
| HCOOH | Муравьиная кислота | HCO- | Формил- |
| CH3COOH | Уксусная кислота | CH3CO- | Ацетил- |
| CH3CH2CH2COOH | Масляная кислота | CH3CH2CH2CO- | Бутирил- |
| HOOOCCOOH | Щавелевая кислота | -OCCO- | Оксалил- |
| HOOC(CH2)2COOH | Янтарная кислота | -OC(CH2)2CO- | Сукцинил- |
Структура и физические свойства карбоновых кислот
Сходство карбоксильной группы как с кетонами, так и со спиртами может свидетельствовать об аналогичных физических свойствах. Как и в кетонах, атом углерода функциональной группы имеет sp2-гибридизацию. Это напрямую связано с его плоской структурой и углами около 120o между связями C-C-O и O-C-O. Например, уксусная кислота CH3COOH имеет углы между связями, равные:
- 119o для C-C=O,
- 119o для C-C-OH,
- 122o для O=C-OH.
В то время как длины связей составляют:
- 1,52Å для C-C,
- 1,25Å для C=O,
- 1,31Å для C-OH.
Карбоновые кислоты проявляют сходство со спиртами из-за их сильной ассоциации, вызванной возможностью образования водородных связей. На практике большинство этих соединений существуют в виде циклических димеров, структура которых формируется за счет образования водородных связей. Такая специфическая система водородных связей влияет и на температуру кипения карбоновых кислот. Это приводит к их значительному увеличению по сравнению с соответствующими спиртами. Например, физические константы — температура плавления и температура кипения в градусах Цельсия соответственно для:
- муравьиной кислоты: 8,4; 100,7,
- уксусной кислоты: 16,6; 117,9,
- пропановой кислоты: -20,8; 141,
- бензойной кислоты: 122,1; 249.
Диссоциация карбоновых кислот
Кислотные свойства этой группы соединений позволяют реагировать с основаниями, включая гидроксид натрия и бикарбонат калия. Продуктами таких реакций являются соли карбоновых кислот. Растворимость карбоновых кислот в воде незначительна, но их соли с щелочными металлами благодаря своему ионному строению очень хорошо растворяются в воде. Эти соединения, являющиеся кислотами в теории Брёнстеда-Лоури, диссоциируют в разбавленных водных растворах. В результате диссоциации образуются: карбоксилат-анион RCOO— и гидроксоний-катион H3O+.
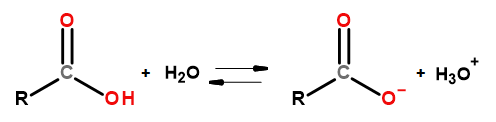
Рисунок 3 Схема диссоциации карбоновой кислоты.
По аналогии с другими кислотами можно записать константу кислотности (Ka) и ее логарифм:
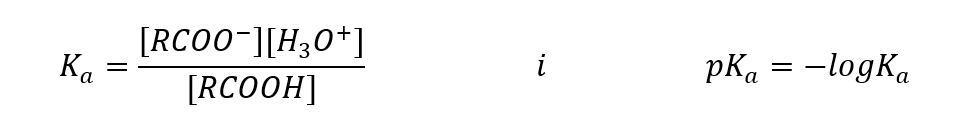
Эмпирически определенные значения для карбоновых кислот показывают, что они являются слабодиссоциированными соединениями, поэтому на практике они также являются слабыми кислотами. Для большинства из них константа Ka составляет около 10-5. Для уксусной кислоты
Ka = 1,76·10-5, что после вычисления дает значение pKa 4,75. Степень диссоциации составляет примерно 0,1% молекул, что по сравнению с сильными неорганическими кислотами со степенью диссоциации 100 % подтверждает, что это малосильные кислоты. По сравнению со спиртами, константы равновесия которых колеблются в пределах 10-16, карбоновые кислоты намного сильнее. Несмотря на их структурное сходство, этот факт связан со стабильностью карбоксилат-аниона по сравнению с алкоксид-анионом. Необходимо обратить внимание, что отрицательный заряд в алкоксидах находится на одном атоме кислорода, который сильно электроотрицателен. В то время как в карбоксилат-анионах заряд делокализуется между двумя атомами кислорода функциональной группы. Это делает его более стабильным по сравнению с анионом, производимым спиртами.
Получение карбоновых кислот
- Окисление замещенных алкилбензолов с помощью KMnO4 или Na2Cr2O7 с продуктом в виде замещенных бензойных кислот. Возможным является окисление первичных и вторичных алкильных групп,
- Окисление связи C=C в алкенах по крайней мере с одним виниловым атомом водорода с помощью KMnO4,
- Окисление первичных спиртов и альдегидов. Спирты с использованием реактива Джонса и альдегиды с использованием того же реактива и основного оксида серебра,
- Гидролиз нитрилов под воздействием сильных, горячих растворов кислот или оснований,
- Реакция соединений Гриньяра с углекислым газом, с промежуточным продуктом в виде карбоксилата магния. Затем промежуточное соединение реагирует с кислотой.
Реакции карбоновых кислот
Благодаря своей структуре карбоновые кислоты, помимо характерных для себя реакций, также претерпевают диссоциации, подобные спиртам и кетонам. Подобно спиртам, они могут диссоциировать протон с образованием нуклеофильного агента. Подобно кетонам, они подвергаются атакам других нуклеофильных агентов на атом углерода карбонильной группы. Кроме того, возможно их восстановление, альфа-замещение, нуклеофильное замещение ацильной группы и депротонирование (диссоциация).
Восстановление карбоновых кислот происходит с помощью LiAlH4 с образованием продукта в виде первичного спирта. Иногда для повышения эффективности необходимо применять нагрев в растворе тетрагидрофурана. Другой способ — восстановление с использованием борана в растворе тетрагидрофурана, также с получением спиртов 1o.
