Melihat strukturnya, asid karboksilik adalah sebatian organik yang penting, dan ia adalah derivatif asil. Mereka adalah sejenis bahan binaan untuk banyak derivatif, termasuk ester dan amida. Secara semula jadi, kita boleh menemui rangkaian keseluruhan pelbagai asid karboksilik, seperti asid asetik CH 3 COOH, yang merupakan sebatian asas cuka meja, asid butirik CH 3 CH 2 CH 2 COOH yang bertanggungjawab untuk bau mentega tengik, atau lebih. asid kolik kompleks, yang merupakan komponen asas jus hempedu manusia.

Formula am asid karboksilik ialah:
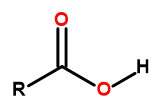
Rajah1 Formula am asid karboksilik ialah:
Nomenklatur asid karboksilik
Menurut sistem tatanama IUPAC, asid karboksilik boleh dinamakan dalam dua cara, bergantung kepada saiz dan kerumitan molekul. Asid yang merupakan terbitan alifatik dinamakan secara sistematik dengan menukar alkana yang berakhiran daripada -ana kepada -oik dan menambah perkataan awal "asid", contohnya, asid propanoik, asid butanoik, asid 3-etil-6-metiloctanedioik. Penomboran atom karbon dalam sebatian kimia tersebut sentiasa bermula dengan atom dalam kumpulan berfungsi –COOH. Sistem penamaan kedua, terutamanya berguna untuk asid di mana kumpulan karboksil dilekatkan pada cincin, dibenarkan untuk menambah perkataan "asid" sebelum dan "karboksilik" selepasnya kepada nama sistematik sebatian. Dalam kes sedemikian, penomboran atom karbon bermula dengan atom yang mana kumpulan karboksil terikat, yang dengan sendirinya dianggap sebagai substituen.
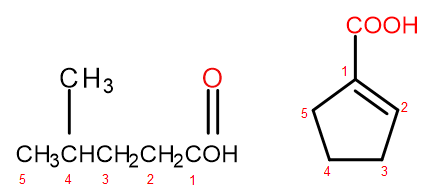
Rajah 2 Penomboran atom karbon dalam, dari kiri ke kanan: asid 4-metilpentanoik, asid 1-siklopentenekarboksilik.
| Asid karboksilik | Kumpulan asil | ||
| Struktur | Nama | Struktur | Nama |
| HCOOH | Formik | HCO- | Formil- |
| CH 3 COOH | Asetik | CH 3 CO- | asetil- |
| CH 3 CH 2 CH 2 COOH | Butyric | CH 3 CH 2 CH 2 CO- | Butyryl- |
| HOOOCCOOH | oksalik | -OCCO- | Oxalil- |
| HOOC(CH 2 ) 2 COOH | Succinic | -OC(CH 2 ) 2 CO- | Succinyl- |
Struktur dan sifat fizikal asid karboksilik
Persamaan kumpulan karboksil kepada kedua-dua keton dan alkohol mungkin mencadangkan sifat fizikal yang serupa. Seperti dalam keton, atom karbon kumpulan berfungsi mempunyai hibridisasi sp 2 . Ini berkaitan secara langsung dengan struktur rata dan sudut kira-kira 120 o antara ikatan CCO dan OCO. Sebagai contoh, asid asetik CH 3 COOH mempunyai sudut ikatan sama dengan:
- 119 o untuk CC=O,
- 119 o untuk CC-OH,
- 122 o untuk O=C-OH.
Panjang ikatan adalah seperti berikut:
- 52Å untuk CC,
- 25Å untuk C=O,
- 31Å untuk C-OH.
Asid karboksilik menunjukkan persamaannya dengan alkohol kerana perkaitannya yang kuat disebabkan oleh kemungkinan membentuk ikatan hidrogen. Dalam amalan, kebanyakan sebatian ini wujud sebagai dimer kitaran yang strukturnya dikekalkan oleh pembentukan ikatan hidrogen. Sistem ikatan hidrogen tertentu sedemikian juga mempengaruhi takat didih asid karboksilik. Ia menyebabkan peningkatan ketara mereka berbanding dengan alkohol yang sepadan. Sebagai contoh, pemalar fizikal – takat lebur dan takat didih dalam darjah Celsius masing-masing adalah:
- Asid format : 8.4; 100.7,
- Asid asetik: 16.6; 117.9,
- Asid propanoik: -20.8; 141,
- Asid benzoik: 122.1; 249.
Pemisahan asid karboksilik
Sifat berasid kumpulan sebatian ini membolehkan mereka bertindak balas dengan bes, termasuk natrium hidroksida dan kalium bikarbonat. Hasil tindak balas tersebut ialah garam asid karboksilik. Keterlarutan asid karboksilik dalam air boleh diabaikan, tetapi garamnya dengan logam alkali, disebabkan oleh struktur ioniknya, larut dengan baik di dalam air. Sebatian ini, iaitu asid dalam teori Bronsted-Lowry, tercerai dalam larutan akueus cair. Hasil daripada penjelmaan, anion karboksilat RCOO – dan kation hidronium H 3 O + terbentuk.
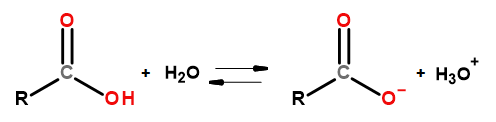
Rajah 3Skema pemisahan asid karboksilik.
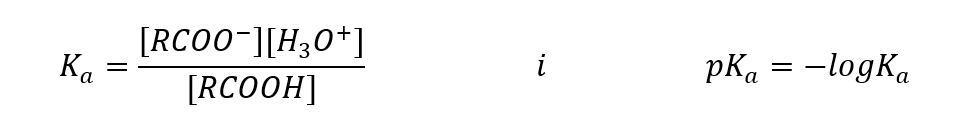 Nilai yang ditentukan secara empirikal untuk asid karboksilik menunjukkan bahawa ia adalah sebatian terdisosiasi lemah, jadi dalam praktiknya ia juga merupakan asid lemah. Bagi kebanyakan mereka, pemalar K a mengambil nilai kira-kira 10 -5 . Untuk asid asetik K a = 1.76·10 -5 , yang, selepas penukaran, memberikan nilai pK bersamaan dengan 4.75. Ini sama dengan pemisahan hanya kira-kira 0.1 %daripada molekul, yang, berbanding dengan asid tak organik yang kuat dengan tahap penceraian 100%, mengesahkan bahawa ini adalah asid kekuatan rendah. Berbanding dengan alkohol, yang pemalar keseimbangannya berayun dalam susunan magnitud 10 -16 , asid karboksilik adalah lebih kuat. Walaupun persamaan strukturnya, fakta ini disebabkan oleh kestabilan anion karboksilat berbanding dengan anion alkoksida. Perhatikan bahawa cas negatif dalam alkoksida adalah pada atom oksigen tunggal, yang sangat elektronegatif. Sebaliknya, dalam anion karboksilat, cas diasingkan antara dua oksigen kumpulan berfungsi. Ini menjadikannya lebih stabil berbanding dengan anion yang dihasilkan oleh alkohol.
Nilai yang ditentukan secara empirikal untuk asid karboksilik menunjukkan bahawa ia adalah sebatian terdisosiasi lemah, jadi dalam praktiknya ia juga merupakan asid lemah. Bagi kebanyakan mereka, pemalar K a mengambil nilai kira-kira 10 -5 . Untuk asid asetik K a = 1.76·10 -5 , yang, selepas penukaran, memberikan nilai pK bersamaan dengan 4.75. Ini sama dengan pemisahan hanya kira-kira 0.1 %daripada molekul, yang, berbanding dengan asid tak organik yang kuat dengan tahap penceraian 100%, mengesahkan bahawa ini adalah asid kekuatan rendah. Berbanding dengan alkohol, yang pemalar keseimbangannya berayun dalam susunan magnitud 10 -16 , asid karboksilik adalah lebih kuat. Walaupun persamaan strukturnya, fakta ini disebabkan oleh kestabilan anion karboksilat berbanding dengan anion alkoksida. Perhatikan bahawa cas negatif dalam alkoksida adalah pada atom oksigen tunggal, yang sangat elektronegatif. Sebaliknya, dalam anion karboksilat, cas diasingkan antara dua oksigen kumpulan berfungsi. Ini menjadikannya lebih stabil berbanding dengan anion yang dihasilkan oleh alkohol.
Mendapatkan asid karboksilik
- Pengoksidaan alkilbenzena tersubstitusi dengan KMnO 4 atau Na 2 Cr 2 O 7 dengan hasil darab dalam bentuk asid benzoik tersubstitusi. Adalah mungkin untuk mengoksidakan kumpulan alkil primer dan sekunder,
- Pengoksidaan ikatan C=C dalam alkena dengan sekurang-kurangnya satu atom hidrogen vinil menggunakan KMnO 4 ,
- Pengoksidaan alkohol primer dan aldehid. Alkohol menggunakan reagen Jones, aldehid menggunakan reagen yang sama dan oksida perak asas,
- Hidrolisis nitril di bawah pengaruh larutan asid atau bes yang kuat dan panas,
- Tindak balas sebatian Grignard dengan karbon dioksida, dengan produk perantaraan dalam bentuk magnesium karboksilat. Sebatian peralihan kemudiannya bertindak balas dengan asid.
Tindak balas asid karboksilik
Oleh kerana strukturnya, asid karboksilik, sebagai tambahan kepada tindak balas ciri mereka, juga mengalami transformasi yang serupa dengan alkohol dan keton. Seperti alkohol, mereka boleh memisahkan proton untuk membentuk reagen nukleofilik. Seperti keton, mereka tertakluk kepada serangan oleh nukleofil lain pada atom karbon kumpulan karbonil. Di samping itu, pengurangan mereka, penggantian dalam kedudukan alfa, penggantian nukleofilik kumpulan asil dan penyahprotonan (dissosiasi) adalah mungkin. Pengurangan asid karboksilik berlaku dengan LiAlH 4 , memberikan produk sebagai alkohol primer. Kadang-kadang perlu menggunakan pemanasan dalam larutan tetrahydrofuran untuk meningkatkan kecekapan. Kaedah lain ialah pengurangan menggunakan borana dalam larutan tetrahydrofuran, juga mendapatkan 1 o alkohol.

