В случае химических реакций только для небольшой их части наблюдается полное превращение субстратов в продукты. Подавляющее большинство из них, включая те, которые происходят в нашем организме, обратимы. Для таких процессов устанавливается состояние химического равновесия. Это чрезвычайно важное понятие в химии, с которым, например, связан принцип Ле Шателье — Брауна. Знание основных законов и правил химического равновесия позволяет, например, предсказывать многие реакции или более эффективно осуществлять технологические процессы.
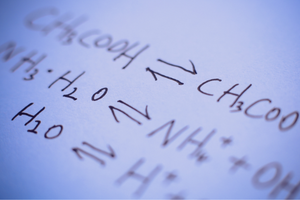
Обратимые и необратимые реакции
Рассматривая ход химических реакций, можно в общем смысле классифицировать их на обратимые и необратимые реакции. Однако следует помнить, что в действительности не существует 100% необратимых реакций, и отнесение к той или иной группе основывается на преобладающем конечном результате.
Необратимые реакции
В этом случае субстраты, находящиеся в системе, вступают в реакцию с получением конкретных продуктов. В отличие от этого, обратного превращения — продуктов в субстраты — не происходит. В записи между реагентами находится одна стрелка, наконечник которой направлен в сторону продуктов.
К необратимым реакциям относятся, прежде всего, все те, в которых образуются осадки. На практике они нерастворимы в воде и не могут быть восстановлены. Обратимость процесса также труднодостижима в случае реакций, протекающих в открытых системах, то есть, например, в химическом стакане или сферической колбе, из которой может свободно выходить один из образующихся продуктов, например, углекислый газ. Но изменив условия реакции, то есть переместив ее в закрытую систему, можно сделать ее обратимой. Кроме того, к группе необратимых реакций относятся все процессы, в которых взаимодействие между молекулами продуктов намного меньше, чем между субстратами. Поэтому такой процесс происходит в двух направлениях, но поскольку восстановление субстратов ничтожно мало, на практике ее классифицируют как необратимую реакцию.
Обратимые реакции
Это реакции, в которых из субстратов образуются продукты и в то же время со сравнимой интенсивностью происходит обратный процесс — восстановление субстратов из продуктов. В записи реакции, между реагентами помещают две стрелки, причем наконечники стрелок направлены в противоположные стороны, чтобы указать на обратимость происходящих реакций.
Обратимые реакции — это в основном реакции, протекающие в закрытых системах. Молекулы субстратов и продуктов не могут покинуть реакционную среду и сталкиваются друг с другом, образуя продукты и восстанавливая субстраты. В качестве примера такой реакции можно привести получение иодоводорода из иода и водорода.
Состояние химического равновесия
Может ли протекать реакция, является ли она обратимой или необратимой, во многом зависит от заданных условий процесса и его типа. Если происходит обратимая реакция, т.е. субстраты превращаются в продукты в результате химической реакции и в то же время субстраты восстанавливаются в результате столкновений между молекулами продуктов, то в какой-то момент времени в ходе этих реакций устанавливается состояние химического равновесия. Другими словами, можно сказать, что концентрации субстратов и продуктов в системе находятся на постоянном уровне — их количество не меняется, несмотря на непрерывное протекание реакции. При химическом равновесии скорости реакций в обоих направлениях одинаковы. Химическое равновесие при определенных условиях означает для данной системы состояние с наибольшей устойчивостью. При этом потребность в энергии низкая.
Константа химического равновесия K — это коэффициент, который описывает равновесие двух обратимых реакций. Он определяется как коэффициент произведений концентраций продуктов и субстрата, возведенных в степень в соответствии со стехиометрическими коэффициентами, которые были измерены при химическом равновесии. Формула для константы была сформулирована в 1864 году как так называемый закон действия масс. Обратите внимание, что эта величина зависит от конкретной реакции.
На состояние химического равновесия влияет ряд факторов. Вот некоторые из них:
- Температура,
- объем реакционной системы,
- давление,
- концентрация реагентов.
Важно отметить, что на положение равновесного состояния не влияет добавление или изменение катализатора реакции. Его задача заключается лишь в том, чтобы сократить время, в течение которого достигается равновесие.
Принцип Ле Шателье — Брауна
Изменяя определенные условия реакции, можно повлиять на ее равновесное состояние. Система будет стремиться постоянно поддерживать равновесие, так как это энергетически выгодно для нее (наименьшие затраты энергии). Следовательно, будут происходить изменения, направленные на противодействие факторам, выводящим систему из равновесия. Это явление было объяснено в 1881 году и сегодня известно как принцип Ле Шателье — Брауна. Оно позволяет понять реакцию системы на изменение условий реакции, находящейся в химическом равновесии.
Добавление в систему одного из реагирующих веществ вызывает нарушение равновесного состояния. Концентрации каждого отдельного реагента подвержены изменениям. Следовательно, чтобы противостоять этому, система стремится произвести больше продукта (при добавлении субстрата) или восстановить субстрат (при добавлении определенного количества продукта).
Изменение температуры реакции оказывает огромное влияние, особенно для эндотермических и экзотермических процессов. В первом из упомянутых случае требуется поступление энергии в систему в виде тепла, поэтому повышение температуры всего процесса сместит равновесие вправо (понижение — влево), в сторону образования большего количества продукта. Для экзотермических реакций, в которых одним из продуктов является тепло, ситуация будет противоположной. Температура не влияет на равновесие реакции, в котором не наблюдается тепловой эффект.
Для газофазных реакций, с другой стороны, давление является очень важным аспектом. Увеличение значения этого параметра, т.е., например, уменьшение реакционного объема системы, приведет к смещению равновесия реакции. Направление изменений зависит от стехиометрических коэффициентов в уравнении реакции. Этот параметр не повлияет на состояние химического равновесия реакции, в котором сумма стехиометрических коэффициентов газообразных субстратов и продуктов одинакова.
Стоит помнить, что при нарушении химического равновесия системы начинает действовать принцип Ле Шателье — Брауна, и в результате возникает новое равновесное состояние.
