Kimyasal reaksiyonlar durumunda, substratların tamamen ürünlere dönüşmesi sadece küçük bir kısmı için gözlenir. Vücudumuzda meydana gelenler de dahil olmak üzere büyük çoğunluğu geri dönüşümlüdür. Bu tür işlemler için, bir kimyasal denge durumu kurulur. Bu, örneğin Le Chatelier ilkesi (veya Denge Yasası) ile ilişkili olan kimyada son derece önemli bir kavramdır. Kimyasal denge ile ilgili temel yasa ve ilkelerin bilgisi, örneğin, birçok reaksiyonun önceden tahmin edilmesini veya teknolojik süreçlerin daha verimli şekilde yürütülmesini sağlar.
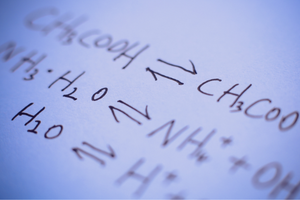
Geri dönüşümlü ve geri dönüşümsüz reaksiyonlar
Kimyasal reaksiyonların gidişatı göz önünde bulundurularak, genel bir ayrım yapılabilir – tersinir ve tersinmez reaksiyonlar olarak. Bununla birlikte, gerçekte %100 geri döndürülemez reaksiyonların olmadığı ve belirli bir gruba kalifikasyonun hakim olan nihai etkiye dayandığı unutulmamalıdır.
geri dönüşümsüz reaksiyonlar
Bu durumda, sistemdeki substratlar reaksiyona girer ve belirli ürünlerle sonuçlanır. Bununla birlikte, ters dönüşüm yoktur – ürünler substratlara dönüşür . Formülde, reaktanlar arasında tek bir ok işaretlenmiştir ve ok, ürünleri işaret etmektedir. Geri dönüşümsüz reaksiyonlar, öncelikle çökeltilerin oluştuğu tüm reaksiyonlardır. Pratikte suda çözünmezler ve sulandırılamazlar. Açık sistemlerde, örneğin bir beher veya küresel bir şişede meydana gelen reaksiyonlar durumunda, prosesin tersine çevrilebilirliğini elde etmek de zordur, örneğin karbon dioksit gibi sonuçtaki ürünlerden biri, ancak koşulları değiştirerek serbestçe kaçabilir. yani kapalı bir sisteme aktarılarak geri dönüşümlü hale getirilebilir. Tersinir olmayan reaksiyonlar grubu ayrıca, ürün molekülleri arasındaki etkileşimin substratlar arasındakinden çok daha az olduğu tüm süreçleri içerir. Bu nedenle, böyle bir süreç her iki yönde de gerçekleşir, ancak substratların sulandırılmasının ihmal edilebilir olması nedeniyle pratikte bunlar geri döndürülemez reaksiyonlar olarak sınıflandırılır.
Tersinir reaksiyonlar
Bunlar, ürünlerin substratlardan oluşturulduğu ve aynı zamanda karşılaştırılabilir yoğunlukta ters işlemin, yani ürünlerden substratların yeniden oluşturulmasının meydana geldiği reaksiyonlardır. Reaksiyon formülünde, meydana gelen reaksiyonların tersinirliğini belirtmek için reaktanlar arasına, oklar zıt yönleri gösterecek şekilde iki ok yerleştirilir. Tersinir reaksiyonlar, esas olarak kapalı sistemlerde gerçekleştirilen reaksiyonlardır. Substrat ve ürünlerin molekülleri reaksiyon ortamından ayrılamazlar ve birbirleriyle çarpışarak ürünler oluşturur ve substratları yeniden oluştururlar. Böyle bir reaksiyonun bir örneği, iyot ve hidrojenden hidrojen iyodür üretimidir.
Kimyasal denge durumu
Belirli bir reaksiyonun gerçekleşip gerçekleşmeyeceği veya tersinir veya tersinmez olup olmadığı, büyük ölçüde belirli proses koşullarına ve proses tipine bağlıdır. Tersine çevrilebilir bir reaksiyon meydana gelirse, yani substratlar bir kimyasal reaksiyonun sonucu olarak ürünlere dönüşürse ve aynı zamanda ürün moleküllerinin çarpışmasının bir sonucu olarak substratlar rekreasyona uğrarsa, o zaman bu reaksiyonların meydana geldiği herhangi bir zamanda, kimyasal denge durumu kurulur . Başka bir deyişle, sistemdeki substrat ve ürünlerin konsantrasyonları sabit bir seviyededir – sürekli reaksiyona rağmen miktarları değişmez. Kimyasal denge durumunda, her iki yöndeki reaksiyon hızları aynıdır. Belirli koşullar altında kimyasal denge, belirli bir sistem için en kararlı durum anlamına gelir. Bu durumda enerji gereksinimi çok düşüktür. Kimyasal denge sabiti K , iki tersinir reaksiyonun dengesini tanımlayan bir katsayıdır. Kimyasal denge durumunda ölçülen stokiyometrik katsayılara karşılık gelen güçlere yükseltilmiş ürün ve substrat konsantrasyonlarının bölümü olarak tanımlanır. Sabitin formülü, 1864’te sözde kütle eylemi yasası olarak türetildi. Bunun belirli bir reaksiyon için karakteristik bir değer olduğu unutulmamalıdır. Bir dizi faktör kimyasal denge durumunu etkiler. Bunlardan bazıları:
- Sıcaklık,
- reaksiyon sisteminin hacmi,
- basınç,
- reaktanların konsantrasyonu.
Önemli olan, denge durumunun konumu, reaksiyon katalizörünün eklenmesinden veya değiştirilmesinden etkilenmez. Görevi sadece dengeye ulaşılan süreyi kısaltmak. 
Le Chatelier ilkesi (Denge Yasası)
Belirli reaksiyon koşullarını değiştirerek dengesini etkileyebiliriz. Sistem her zaman dengeyi korumaya çalışacaktır, çünkü enerjisel olarak kendisi için uygundur (en düşük enerji harcaması). Sonuç olarak, sistemi dengeden çıkaran faktörlere karşı koyan değişiklikler olacaktır. Bu fenomen 1881’de açıklandı ve bugün Le Chatelier-Braun ilkesi veya Denge Yasası olarak biliniyor. Kimyasal denge durumunda olan bir reaksiyon koşullarındaki değişikliklere sistemin tepkisini anlamayı sağlar. Tepkimeye giren maddelerden birinin sisteme eklenmesi dengenin bozulmasına neden olur. Bireysel reaktanların konsantrasyonları değişir. Böylece, buna karşı koymak için, sistem daha fazla ürün üretme (bir substrat eklendiğinde) veya substratı yeniden oluşturma (belirli bir miktarda ürün eklendiğinde) eğilimindedir. Reaksiyon sıcaklığının değiştirilmesi, özellikle endotermik ve ekzotermik süreçler için çok büyük bir etkiye sahiptir. İlk durumda, sisteme ısı şeklinde enerji sağlamak gerekir, bu nedenle tüm sürecin sıcaklığının arttırılması dengeyi sağa kaydırır (sola düşürmek), daha fazla ürün oluşumuna doğru. . Tersi, ürünlerden birinin ısı olduğu ekzotermik reaksiyonlar için geçerli olacaktır. Sıcaklığın, termal etkinin gözlenmediği reaksiyonun dengesi üzerinde hiçbir etkisi yoktur. Gaz fazında meydana gelen reaksiyonlarda basınç çok önemli bir husustur. Bu parametrenin değerinin arttırılması yani sistemin reaksiyon hacminin düşürülmesi reaksiyon dengesinin kaymasına neden olacaktır. Değişikliklerin yönü, reaksiyon denklemindeki stokiyometrik katsayılara bağlıdır. Bu parametre, gaz halindeki substratların ve ürünlerin stokiyometrik katsayılarının toplamının aynı olduğu reaksiyonun kimyasal dengesini etkilemeyecektir. Unutulmamalıdır ki, sistem kimyasal dengeden dışarı atıldığında Denge Yasası devreye girecek ve bunun sonucunda yeni bir denge durumuna ulaşılacaktır.

