No caso de reações químicas, a conversão completa de substratos em produtos é observada apenas em uma pequena parte deles. A grande maioria, inclusive as que ocorrem em nosso corpo, são reversíveis. Para tais processos, um estado de equilíbrio químico é estabelecido. Este é um conceito extremamente importante em química, que está associado, por exemplo, ao princípio de Le Chatelier (ou Lei do Equilíbrio). O conhecimento das leis e princípios básicos relativos ao equilíbrio químico permite, por exemplo, prever muitas reações ou conduzir processos tecnológicos de forma mais eficiente.
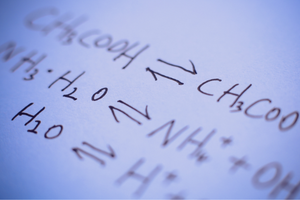
Reações reversíveis e irreversíveis
Levando em consideração o curso das reações químicas, pode-se fazer uma divisão geral – em reações reversíveis e irreversíveis. No entanto, deve-se lembrar que na realidade não existem reações 100%irreversíveis, e a qualificação para um determinado grupo é baseada no efeito final predominante.
Reações irreversíveis
Nesse caso, os substratos do sistema reagem e resultam em produtos específicos. No entanto, não há transformação reversa – produtos em substratos . Na fórmula, uma única seta é marcada entre os reagentes e a seta aponta para os produtos. As reações irreversíveis são principalmente todas aquelas em que se formam precipitados. Na prática, são insolúveis em água e não podem ser reconstituídos. A reversibilidade do processo também é difícil de alcançar no caso de reações que ocorrem em sistemas abertos, ou seja, em um béquer ou balão esférico, do qual um dos produtos resultantes, por exemplo, dióxido de carbono, pode escapar livremente, mas alterando as condições da reação, ou seja, transferindo-a para um sistema fechado, ela pode ser revertida. O grupo de reações irreversíveis também inclui todos os processos em que a interação entre as moléculas do produto ocorre em uma extensão muito menor do que entre os substratos. Assim, tal processo ocorre em ambas as direções, mas devido ao fato da reconstituição dos substratos ser desprezível, na prática elas são classificadas como reações irreversíveis.
Reações reversíveis
São reações nas quais produtos são formados a partir de substratos e, ao mesmo tempo, o processo inverso ocorre com intensidade comparável – ou seja, a reconstituição de substratos a partir de produtos. Na fórmula da reação, duas setas são colocadas entre os reagentes, com as setas apontando em direções opostas, para indicar a reversibilidade das reações que ocorrem. As reações reversíveis são principalmente aquelas que são realizadas em sistemas fechados. Moléculas de substratos e produtos não conseguem sair do ambiente de reação e colidem entre si, criando produtos e reconstituindo substratos. Um exemplo de tal reação é a produção de iodeto de hidrogênio a partir de iodo e hidrogênio.
O estado de equilíbrio químico
Se uma determinada reação pode ocorrer, ou se é reversível ou irreversível, depende muito das condições particulares do processo e do tipo de processo. Se ocorrer uma reação reversível, ou seja, os substratos se transformam em produtos como resultado de uma reação química e, ao mesmo tempo, como resultado de colisões de moléculas do produto, os substratos sofrem recriação, então, em algum momento em que essas reações ocorrem, um estado de equilíbrio químico é estabelecido . Em outras palavras, as concentrações de substratos e produtos no sistema estão em um nível constante – sua quantidade não muda apesar da reação contínua. No estado de equilíbrio químico, as taxas de reação em ambas as direções são as mesmas. O equilíbrio químico, sob certas condições, significa o estado mais estável para um determinado sistema. A necessidade de energia é então muito baixa. A constante de equilíbrio químico, K , é um coeficiente que descreve o equilíbrio de duas reações reversíveis. É definido como o quociente das concentrações de produtos e substratos elevados às potências correspondentes aos coeficientes estequiométricos que foram medidos no estado de equilíbrio químico. A fórmula para a constante foi derivada em 1864 como a chamada lei da ação das massas. Deve ser lembrado que este é um valor característico para uma reação particular. Vários fatores afetam o estado de equilíbrio químico. Estes são alguns deles:
- Temperatura,
- volume do sistema de reação,
- pressão,
- concentração de reagentes.
O que é importante, a posição do estado de equilíbrio não é afetada pela adição ou mudança do catalisador da reação. Sua tarefa é apenas encurtar o tempo durante o qual o equilíbrio é alcançado. 
Princípio de Le Chatelier (Lei do Equilíbrio)
Ao alterar certas condições de reação, podemos influenciar seu equilíbrio. O sistema sempre se esforçará para manter o equilíbrio, pois é energeticamente favorável a ele (menor gasto energético). Como consequência, haverá mudanças que neutralizam os fatores que desequilibram o sistema. Esse fenômeno foi explicado em 1881 e hoje é conhecido como princípio de Le Chatelier-Braun ou como Lei do Equilíbrio. Permite entender a resposta do sistema a mudanças nas condições de uma reação, que se encontra em estado de equilíbrio químico. A adição de uma das substâncias reagentes ao sistema causa uma perturbação no equilíbrio. As concentrações dos reagentes individuais mudam. Assim, para contrariar isto, o sistema tende a produzir mais produto (quando se adiciona um substrato) ou a reconstituir o substrato (quando se adiciona uma certa quantidade de produto). Alterar a temperatura da reação tem um grande impacto, especialmente para processos endotérmicos e exotérmicos. No caso do primeiro, é necessário fornecer energia ao sistema na forma de calor, de modo que o aumento da temperatura de todo o processo deslocará o equilíbrio para a direita (diminuindo para a esquerda), no sentido da formação de mais produto . O oposto será o caso de reações exotérmicas, onde um dos produtos é o calor. A temperatura não tem efeito sobre o equilíbrio da reação, onde nenhum efeito térmico é observado. No caso de reações que ocorrem na fase gasosa, a pressão é um aspecto muito importante. Aumentar o valor deste parâmetro, ou seja, reduzir o volume de reação do sistema, fará com que o equilíbrio da reação se desloque. A direção das mudanças depende dos coeficientes estequiométricos na equação da reação. Este parâmetro não afetará o equilíbrio químico da reação em que a soma dos coeficientes estequiométricos dos substratos gasosos e dos produtos é a mesma. Vale lembrar que quando o sistema for retirado do equilíbrio químico, a Lei do Equilíbrio será aplicada e, como resultado, um novo estado de equilíbrio será alcançado.

