W przypadku reakcji chemicznych, tylko dla niewielkiej części obserwuje się całkowite przereagowanie substratów do produktów. Zdecydowana większość, również tych przebiegających w naszym organizmie, jest odwracalna. Dla takich procesów ustala się stan równowagi chemicznej. Jest to niezwykle ważne pojęcie w chemii, z którym wiąże się np. reguła przekory. Znajomość podstawowych praw i reguł dotyczących równowagi chemicznej pozwala np. na przewidywanie wielu reakcji lub wydajniejsze prowadzenie procesów technologicznych.
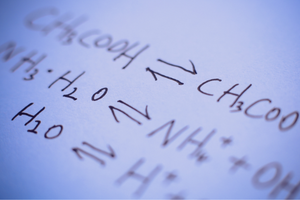
Reakcje odwracalne i nieodwracalne
Biorąc pod uwagę przebieg reakcji chemicznych, można dokonać ogólnego podziału na reakcje odwracalne i nieodwracalne. Należy jednak pamiętać, że w rzeczywistości nie występują reakcje w 100% nieodwracalne, a kwalifikacja do danej grupy następuje na podstawie przeważającego efektu końcowego.
Reakcje nieodwracalne
W tym przypadku, substraty znajdujące się w układzie, ulegają przereagowaniu do określonych produktów. Natomiast nie następuje odwrotna przemiana – produktów w substraty. W zapisie, pomiędzy reagentami zaznacza się pojedynczą strzałkę, z grotem skierowanym w kierunku produktów.
Reakcje nieodwracalne to przede wszystkim wszystkie te, w których wytrącają się osady. W praktyce są one nierozpuszczalne w wodzie i nie mogą ulec odtworzeniu. Odwracalność procesu jest także trudna do osiągnięcia w przypadku reakcji przebiegających w układach otwartych, czyli np. w zlewce lub kolbie kulistej, z których swobodnie może ulotnić się jeden z powstających produktów, np. dwutlenek węgla. Ale zmieniając warunki reakcji, czyli przenosząc ją do układu zamkniętego, można sprawić, że będzie odwracalna. Do grupy reakcji nieodwracalnych zalicza się również wszystkie procesy, gdzie interakcja pomiędzy cząsteczkami produktów zachodzi w zdecydowanie mniejszym stopniu niż między substratami. Zatem proces taki zachodzi w dwóch kierunkach, ale z uwagi na to, że odtworzenie substratów jest znikome, zalicza się je w praktyce do reakcji nieodwracalnych.
Reakcje odwracalne
Są to reakcje, w których z substratów powstają produkty i jednocześnie zachodzi odwrotny proces z porównywalną intensywnością, odtwarzania substratów z produktów. W zapisie reakcji, pomiędzy reagentami umieszcza się dwie strzałki, z grotami skierowanymi w przeciwne strony, aby zaznaczyć odwracalność zachodzących reakcji.
Reakcje odwracalne to głównie takie, które prowadzi się w układach zamkniętych. Cząsteczki substratów oraz produktów nie mają możliwości opuszczenia środowiska reakcji i zderzają się ze sobą tworząc produkty i odtwarzając substraty. Jako przykład takiej reakcji można podać otrzymywanie jodowodoru z jodu i wodoru.
Stan równowagi chemicznej
To, czy dana reakcja może zajść, bądź jest odwracalna lub nieodwracalna, zależy w dużej mierze od zadanych warunków procesowych i rodzaju procesu. Jeżeli zachodzi reakcja odwracalna, czyli substraty w wyniku reakcji chemicznej zamieniają się w produkty i jednocześnie w wyniku zderzeń cząsteczek produktów, odtwarzają się substraty, to w pewnym momencie zachodzenia tych reakcji w czasie, dochodzi do ustalenia stanu równowagi chemicznej. Inaczej można powiedzieć, że stężenia substratów i produktów w układzie są na stałym poziomie – ich ilość nie zmienia się pomimo ciągłego zachodzenia reakcji. W stanie równowagi chemicznej, szybkości reakcji w obu kierunkach są takie same. Równowaga chemiczna w określonych warunkach, oznacza dla danego układu stan o największej trwałości. Zapotrzebowanie energii jest wtedy niewielkie.
Stała równowagi chemicznej K, to współczynnik, który opisuje równowagę dwóch odwracalnych reakcji. Definiowana jest, jako iloraz iloczynów stężeń produktów i substratów podniesionych do potęg zgodnych ze współczynnikami stechiometrycznymi, które zostały zmierzone w stanie równowagi chemicznej. Wzór na stałą został sformułowany w 1864 roku, jako tzw. prawo działania mas. Należy pamiętać, że jest to wielkość charakterystyczna dla danej reakcji.
Na stan równowagi chemicznej wpływa szereg czynników. Oto niektóre z nich:
- Temperatura,
- objętość układu reakcyjnego,
- ciśnienie,
- stężenie reagentów.
Co istotne, na położenie stanu równowagi nie ma wpływu dodatek lub zmiana katalizatora reakcji. Jego zadaniem jest jedynie skrócenie czasu, w trakcie którego dochodzi do równowagi.
Reguła przekory
Zmieniając pewne warunki reakcji, można wpływać na jej stan równowagi. Układ będzie cały czas dążył do utrzymania równowagi, ponieważ jest to dla niego korzystne energetycznie (najmniejszy wydatek energii). W konsekwencji, będą zachodzić zmiany przeciwdziałające czynnikom wytrącającym układ z równowagi. Zjawisko to zostało wyjaśnione w 1881 roku i dzisiaj jest znane jako zasada Le Chateliera – Brauna lub jako reguła przekory. Pozwala ona zrozumieć odpowiedź układu na zmiany warunków reakcji, która jest w stanie równowagi chemicznej.
Dodatek do układu jednej z reagujących substancji, powoduje zaburzenie stanu równowagi. Zmianie ulegają stężenia poszczególnych reagentów. Zatem, aby temu przeciwdziałać, układ dąży do wytworzenia większej ilości produktu (gdy dodano substratu) lub odtworzenia substratu (gdy dodano określoną ilość produktu).
Zmiana temperatury reakcji ma ogromny wpływ, szczególnie dla procesów endotermicznych i egzotermicznych. W przypadku pierwszej z wymienionych, do układu niezbędne jest dostarczenie energii na sposób ciepła, zatem podwyższenie temperatury całego procesu będzie przesuwać równowagę w prawą stronę (obniżenie w lewą), w kierunku powstania większej ilości produktu. Odwrotnie sytuacja będzie wyglądać dla reakcji egzotermicznych, gdzie jednym z produktów jest ciepło. Temperatura nie ma wpływu na równowagę reakcji, w której nie obserwuje się efektu termicznego.
Z kolei dla reakcji przebiegających w fazie gazowej, bardzo ważnym aspektem jest ciśnienie. Zwiększenie wartości tego parametru, czyli np. zmniejszenie objętości reakcyjnej układu, spowoduje, że równowaga reakcji zostanie przesunięta. Kierunek zachodzenia zmian uzależniony jest od współczynników stechiometrycznych w równaniu reakcji. Parametr ten nie będzie miał wpływu na stan równowagi chemicznej reakcji, w której suma współczynników stechiometrycznych gazowych substratów i produktów jest taka sama.
Warto pamiętać, że gdy układ zostanie wytrącony ze stanu równowagi chemicznej, zadziała reguła przekory i w wyniku tego dojdzie do osiągnięcia nowego stanu równowagi.
