Рассмотрение энергетики химических реакций является одним из важных элементов в понимании трансформаций, происходящих во время химических перемен. В ходе таких преобразований образуются химические соединения, которые по своей структуре и химическому составу отличаются от сырья, из которого они получены. В ходе химических реакций происходит разрыв связей между атомами молекул, применяемых в качестве реагентов, и образование новых — уже присутствующих в продуктах.

Система и среда химической реакции
Для правильной интерпретации энергетики химических реакций необходимо знание:
- Системы — отдельной области материи, имеющей свои четкие границы. Важен тип системы — открытая, если в ходе реакции происходит обмен энергией и веществом, закрытая, если происходит обмен только энергией, и изолированная, если ни энергия, ни вещество не обмениваются.
- Среды — все, что не принадлежит системе, но находится в ее «окрестностях».
- Составных частей системы — всех веществ, находящихся в рассматриваемой системе и обладающих характерными для них химическими свойствами.
Энергетика химических связей
Энергетический эффект, характеризующий любую химическую реакцию, является результатом изменений, происходящих при разрыве и образовании связей между атомами. Факт, что любой разрыв химической связи тесно связан с поглощением соответствующего количества энергии, в то время как образование новой связи приводит к высвобождению энергии. Отдача энергии в окружающую среду может происходить с различными эффектами — в виде тепла, света, работы или электричества. Каждый из этих процессов является составляющим фактором, влияющим на общее изменение внутренней энергии системы, в которой протекает рассматриваемая реакция. Важным фактом является то, что независимо от того, должны ли реагенты в процессе превращения брать или отдавать энергию, для начала всего процесса всегда требуется определенное количество энергии.
Первый закон термодинамики
Первое важное правило, касающееся энергетики химических реакций, сформулировано в первом законе термодинамики, который гласит, что внутренняя энергия системы, которая обменивается энергией только с окружающей средой (закрытая система), может изменяться только по способу работы и тепла. Это отражено в уравнении Гельмгольца:
∆U = Q + W
Где ΔU представляет собой изменение внутренней энергии, Q — тепло, а W — символизирует работу. Из уравнения видно, что внутренняя энергия изолированной системы, т.е. системы, которая не обменивается энергией или массой с окружающей средой, постоянна.
С другой стороны, компоненты внутренней энергии — это все кинетические энергии атомов, ионов, молекул, электронов и компонентов атомного ядра, присутствующих в реакционной системе, а также энергии их взаимодействий друг с другом, то есть энергии химических связей, взаимодействий между зарядами и тому подобное. Обратите внимание, что внутренняя энергия не включает кинетическую или потенциальную энергию системы в целом. Сумма кинетической и потенциальной энергии системы в целом и внутренней энергии составляет полную энергию системы (E).
Энтальпия системы (H)
Это еще одно важное понятие, связанное с энергетикой химических реакций, означающее на практике сумму внутренней энергии системы и произведения давления и объема. Количественно она представляет собой энергию, которая требуется для создания системы в вакууме (U), дополненную работой, то есть коэффициент давления-объема (pV), необходимый для того, чтобы система совершила работу против внешних сил для получения объема, отличного от нуля. Соотношение, описывающее энтальпию системы, выражается в виде:
H = U + pV
Поведение реакции в такой системе приводит к бесконечно малому изменению энтальпии:
dH = dU + dpV + pdV
Когда условия реакции изобарические, а поэтому давление не меняется в ходе процесса, вторым членом можно пренебречь, поскольку dpV=0. После подстановки дифференциалов в конечные приращения, а также после преобразования выражения, относящегося к изменению внутренней энергии системы, получаем соотношение:
∆H = Q + W + p∆V
Если предположить, что рассматриваемый процесс совершает объемную работу при поддержании стабильного давления, то W = -pΔV, и, следовательно:
∆H = Q — p∆V + p∆V
Из уравнения можно сделать вывод, что если реакция протекает при постоянном давлении, то изменение энтальпии этой системы равно теплоте:
∆H = Q
Энергетический потенциал реакции
В связи с выведенным выше уравнением, свидетельствующим о том, что изменение энтальпии системы может быть равно теплоте реакции, существует классификация процессов по тепловым превращениям. Если классифицировать их по направлению потока энергии, то химические реакции делятся на:
- Экзотермические, т.е. те, в результате которых наблюдается выделение энергии, например, в виде тепла, в окружающую среду системы. Это происходит, когда сумма энтальпий продуктов меньше суммы энтальпий субстратов, т.е. когда ΔH<0
- Эндотермические, т.е. химические превращения, в результате которых происходит поглощение энергии из окружающей среды. Необходимым условием протекания реакции является поступление достаточного количества этой энергии. Это относится ко всем превращениям, для которых общая энтальпия продуктов выше, чем общая энтальпия субстратов, т.е. ΔH>0.
Записи термохимических реакций
При рассмотрении химических реакций, наряду с их энергетическими потребностями и распределениями, тепловые эффекты, характерные для реакций, включаются в обозначения химического уравнения. Для экзотермических реакций абсолютное значение возникающего энергетического эффекта записывается со стороны продукта. Напротив, при записи эндотермической реакции абсолютное значение поглощенной энергии записывается со стороны субстратов. Например:
- Экзотермическая реакция:
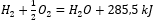
- Эндотермическая реакция: 2H3PO4 + 3Mg(OH)2 + 407kJ = Mg3(PO4)2 + 6H2O
Другой способ — записать уравнение химической реакции, рядом с которым указано значение энергетического эффекта. В этом случае значение, соответствующее энергии экзоэнергетической реакции, отрицательно, а эндоэнергетической — положительно. Например:
- Экзоэнергетическая реакция: Fe + S → FeS ∆H= -95,2 kJ/mol
- Эндоэнергетическая реакция: FeS → Fe + S ∆H= 95,2 kJ/mol
Закон Гесса
Составляет основу термохимических расчетов, утверждая, что независимо от того, как протекает реакция, ее тепловой эффект всегда одинаков. Это позволяет рассчитать стандартную энтальпию реакции (ΔrHϴ), принимая во внимание используемые стандартные условия, т.е. давление 105 Па и произвольную температуру. Поскольку энтальпия является функцией состояния, ее изменение зависит только от двух значений — в начальном состоянии и в конечном состоянии, что в химической реакции означает состояния субстратов и продуктов, соответственно. Закон Гесса выражается уравнением, содержащим стехиометрические коэффициенты (v) и стандартные молярные энтальпии образования (ΔfHϴ):
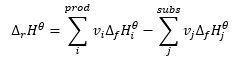
Стандартная молярная энтальпия образования
Это энтальпия, полученная при образовании 1 моля данного химического соединения из элементов в их основных состояниях. Где основным состоянием признается наиболее стабильная разновидность элемента в данных условиях. Например, графит является наиболее стабильной разновидностью углерода при температуре 25 oC и под давлением 105 Па. Напротив, при высоких температурах и давлениях стабильной формой является алмаз.
Для каждого реагента, участвующего в реакции в основном состоянии, значение стандартной молярной энтальпии образования равно нулю. Чаще всего это отдельные атомы инертных газов или наиболее стабильные в данных условиях разновидности других газов. Для стандартного давления (105 Па) и температуры, обычно 25 oC, значения стандартных молярных энтальпий образования соединений собраны в химических таблицах. Единицей измерения этого значения является . Применение закона Гесса к химическим реакциям приводит к тому, что значение энтальпии реакции не зависит от числа промежуточных реакций. Ключевым моментом есть то, что конкретные продукты образуются из конкретных субстратов.
Синтез двуокиси углерода
Процесс синтеза двуокиси углерода может осуществляться различными способами, но согласно закону Гесса каждый из них приводит к одному и тому же значению стандартных изменений энтальпии.
- Прямой синтез
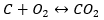
- Синтез окиси углерода (II) + окисление соединения до окиси углерода (IV)
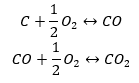
Если вычесть значения стандартных энтальпий образования соединений из таблицы и подставить их в химические уравнения, то энтальпия будет одинаковой для каждого метода, т.е. -393,5 кДж/моль.
Закон Кирхгофа
Позволяет преобразовывать расчеты для вычисления стандартной энтальпии реакции для определенной температуры, если известно ее значение при другой температуре. Также известна температурная зависимость молярной теплоты всех реагентов. Этот закон применим, поскольку изменение энтальпии реакции зависит от условий, при которых она протекает — она изменяется при изменении температуры и давления. Вывод формулы следует начать с определения теплоемкости, т.е. отношения количества подведенного тепла к повышению температуры:
![]()
Предполагая изотермические условия, ее можно преобразовать:
![]()
Масштабирование полученного уравнения и преобразование теплоемкости в член, соответствующий изменению стандартной теплоемкости, отражает уравнение закона Кирхгофа:
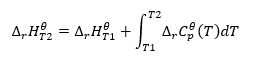
Для стандартных условий изменение теплоемкости реакции описывается уравнением, в котором переменные v — стехиометрические коэффициенты, а также обозначающим стандартную молярную теплоту данного реагента. При небольшой разнице температур (до 100 К) значение стандартной молярной теплоты реагента принимается постоянным в заданном диапазоне. Затем можно использовать упрощенную форму закона Кирхгофа, если предполагается, что теплоемкости реагентов не зависят от температуры, а при постоянном давлении :
![]()
