Rozważanie zagadnienia energetyki reakcji chemicznych jest jednym z ważnych elementów, pozwalających na zrozumienie przemian zachodzących podczas przemiany chemicznej. Podczas takiej przemiany dochodzi do powstawania związków chemicznych o innej budowie oraz składzie chemicznym, aniżeli surowce z których powstają. W trakcie reakcji chemicznych ma miejsce zrywanie wiązań pomiędzy atomami cząsteczek wykorzystywanych w roli reagentów oraz wytwarzanie nowych – obecnych już w produktach.

Układ i otoczenie reakcji chemicznej
Do prawidłowej interpretacji energetycznej reakcji chemicznych niezbędna jest wiedza na temat:
- Układu – wyodrębnionego obszaru materii, który posiada swoje wyraźne granice. Ważny jest typ układu – otwarty, jeżeli w trakcie reakcji dochodzi do wymiany energii i materii, zamknięty gdy zachodzi jedynie wymiana energii oraz izolowany, jeżeli nie dochodzi do wymiany ani energii, ani materii.
- Otoczenia – wszystko, co nie należy do układu, jednak znajduje się w jego pobliżu.
- Składników układu – wszystkich substancji, które znajdują się w rozważanym układzie i posiadają swoje charakterystyczne właściwości chemiczne.
Energetyka wiązań chemicznych
Efekt energetyczny charakteryzujący każdą reakcję chemiczną jest wynikiem zmian zachodzących w trakcie zrywania oraz powstawania wiązań pomiędzy atomami. Faktem jest, że każde zerwanie wiązania chemicznego jest ściśle związane z pochłonięciem odpowiedniej ilości energii, natomiast utworzenie nowego wiązania skutkuje jej wydzielaniem. Oddawanie do otoczenia energii może odbywać się z różnym skutkiem – w formie ciepła, światła, pracy lub elektryczności. Każdy z tych procesów jest czynnikiem składowym, mającym wpływ na ogólną zmianę energii wewnętrznej układu, w którym zachodzi rozważana reakcja. Ważnym faktem jest, że niezależnie od tego, czy reagenty w trakcie przemiany muszą pobierać lub oddawać energię, zawsze wymagana jest pewna jej ilość, niezbędna do zainicjowania całego procesu.
Pierwsza zasada termodynamiki
Pierwszą ważną regułą, dotyczącą energetyki reakcji chemicznych jest, sformułowana w pierwszej zasadzie termodynamiki zależność mówiąca o tym, że energia wewnętrzna układu wymieniającego tylko energię z otoczeniem (układu zamkniętego) może być zmieniana jedynie na sposób pracy i ciepła. Odzwierciedla to równanie Helmholtza:
∆U = Q + W
Gdzie, ΔU oznacza zmianę energii wewnętrznej, Q to ciepło, a W symbolizuje pracę. Ze wzoru można zauważyć, że energia wewnętrzna układu izolowanego, czyli takiego, który nie wymienia energii ani masy z otoczeniem jest stała.
Składnikami energii wewnętrznej są natomiast wszystkie energie kinetyczne atomów, jonów, cząsteczek, elektronów oraz składników jądra atomowego, które obecne są w układzie reakcyjnym, a także energie ich oddziaływań pomiędzy sobą, to znaczy energie wiązań chemicznych, oddziaływania pomiędzy ładunkami i tym podobne. Należy pamiętać, iż energia wewnętrzna nie zawiera energii kinetycznej ani potencjalnej układu jako całości. Suma energii kinetycznej i potencjalnej układu jako całości oraz energii wewnętrznej to całkowita energia układu (E).
Entalpia układu (H)
To koleje ważne pojęcie, związane z energetyką reakcji chemicznych, oznaczające w praktyce sumę energii wewnętrznej układu oraz iloczynu ciśnienia oraz objętości. Ilościowo, stanowi energię, która jest wymagana w celu wytworzenia układu w próżni (U), powiększona o pracę, czyli iloraz ciśnienia i objętości (pV) konieczny do wykonania przez układ przeciwko siłom zewnętrznym w celu uzyskania objętości różnej od zera. Zależność opisująca entalpię układu jest wyrażana w postaci:
H = U + pV
Zachodzenie w takim układzie reakcji skutkuje nieskończenie małą zmianą entalpii:
dH = dU + dpV + pdV
W przypadku, kiedy warunki reakcji są izobaryczne, a więc nie zmienia się ciśnienie w trakcie procesu, drugi człon może zostać pominięty, gdyż dpV=0. Po podstawieniu różniczek na przyrosty skończone oraz po zamianie wyrażenia, odnoszącego się na zmianę energii wewnętrznej układu, otrzymujemy zależność:
∆H = Q + W + p∆V
Zakładając, że rozważany proces wykonuje pracę objętościową z zachowaniem stabilnego ciśnienia, to W = -pΔV, a w konsekwencji:
∆H = Q – p∆V + p∆V
Z równania można wywnioskować, że jeżeli reakcja zachodzi w warunkach niezmiennego ciśnienia, to zmiana entalpii tego układu jest równa ciepłu:
∆H = Q
Możliwości energetyczne reakcji
Ze względu na wyprowadzony powyżej wzór, świadczący o tym, że zmiana entalpii układu może być równa ciepłu reakcji, istnieje podział procesów w zależności od przemian cieplnych. Kategoryzując je pod względem kierunku przepływu energii reakcje chemiczne dzielimy na:
- Egzotermiczne, czyli takie w wyniku których obserwuje się wydzielenie energii, na przykład w postaci ciepła, do otoczenia układu. Dzieje się tak kiedy suma entalpii produktów jest mniejsza niż suma entalpii substratów, czyli wtedy gdy ΔH<0
- Endotermiczne, czyli przemiany chemiczne, w wyniku których zachodzi pochłanianie energii z otoczenia. Warunkiem zajścia reakcji jest dostarczenie odpowiedniej ilości tej energii. Dotyczy to wszystkich przemian, dla których sumaryczna entalpia produktów jest wyższa niż sumaryczna entalpia substratów, a więc ΔH>0.
Zapisy reakcji termochemicznych
W przypadku rozważań reakcji chemicznych, wraz z ich zapotrzebowaniem i rozłożeniem energetycznym, efekty cieplne charakterystyczne dla nich, uwzględnia się w zapisie równania chemicznego. Dla reakcji egzotermicznych, wartość bezwzględną występującego efektu energetycznego, zapisuje się po stronie produktów. Natomiast w trakcie zapisu reakcji endotermicznej, wartość bezwzględna pochłanianej energii, zapisywana jest po stronie substratów. Przykładowo:
- Reakcja egzotermiczna:
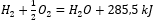
- Reakcja endotermiczna: 2H3PO4 + 3Mg(OH)2 + 407kJ = Mg3(PO4)2 + 6H2O
Innym sposobem jest zapisywanie równania reakcji chemicznej, wraz z podaną obok wartością efektu energetycznego. W takim wypadku, wartość odpowiadająca energii reakcji egzoenergetycznej jest ujemna, natomiast endoenergetycznej dodatnia. Dla przykładu:
- Reakcja egzoenergetyczna: Fe + S → FeS ∆H= -95,2 kJ/mol
- Reakcja endoenergetyczna: FeS → Fe + S ∆H= 95,2 kJ/mol
Prawo Hessa
Stanowi podstawę obliczeń termochemicznych, mówiąc o tym, iż niezależnie od sposobu przeprowadzenia danej reakcji, jej efekt cieplny jest zawsze taki sam. Dzięki temu możliwa do obliczenia jest standardowa entalpia reakcji (ΔrHϴ), przy założeniu użytych warunków standardowych, czyli ciśnienia wynoszącego 105 Pa oraz dowolnej temperatury. Ze względu na to, iż entalpia jest funkcją stanu, jej zmienność zależy jedynie od dwóch wartości – w stanie początkowym oraz końcowym, co w reakcji chemicznej oznacza odpowiednio stan substratów oraz produktów. Prawo Hessa wyraża równanie, zawierające współczynniki stechiometryczne (v) oraz standardowe molowe entalpie tworzenia (ΔfHϴ):
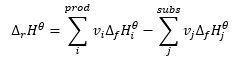
Standardowa molowa entalpia tworzenia
Jest to entalpia, uzyskaną w wyniku tworzenia 1 mola danego związku chemicznego z pierwiastków w ich stanach podstawowych. Gdzie za stan podstawowy uznaje się najtrwalszą odmianę pierwiastka w danych warunkach. Dla przykładu, grafit jest najtrwalszą odmianą węgla w temperaturze 25oC i pod ciśnieniem 105 Pa. Z kolei przy zastosowaniu wysokich temperatur oraz ciśnień, stabilną jego formą jest diament.
Dla każdego reagenta, uczestniczącego w reakcji w stanie podstawowym, wartość standardowej molowej entalpii tworzenia wynosi zero. Najczęściej, są to pojedyncze atomy gazów szlachetnych, czy też najtrwalsze odmiany innych gazów w danych warunkach. Dla ciśnienia standardowego (105 Pa) oraz temperatury, zwykle 25oC, wartości standardowych molowych entalpii tworzenia związków są zebrane w tabelach chemicznych. Jednostką tej wartości jest . Zastosowanie prawa Hessa w reakcjach chemicznych skutkuje faktem, iż wartość entalpii reakcji jest niezależna od ilości reakcji pośrednich. Kluczowe jest jedynie, że z określonych substratów powstają konkretne produkty.
Synteza dwutlenku węgla
Proces syntezy dwutlenku węgla może być przeprowadzony na różne sposoby, jednak zgodnie z prawem Hessa – każdy z nich prowadzi do tej samej wartości zmian standardowych entalpii.
- Bezpośrednia synteza
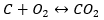
- Synteza tlenku węgla (II) + utlenienie związku do tlenku węgla (IV)
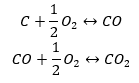
Odczytując z tabeli wartości standardowych entalpii tworzenia związków oraz podstawiając wartości do równań chemicznych, dla każdej z metod entalpia wynosi tyle samo, czyli -393,5 kJ/mol.
Prawo Kirchhoffa
Pozwala na przekształcanie obliczeń, w celu wyliczenia standardowej entalpii reakcji dla pewnej temperatury, jeżeli znana jest jej wartość w innej temperaturze. Znane są również zależności ciepła molowego wszystkich reagentów od temperatury. Prawo jest możliwe do zastosowania, gdyż zmiana entalpii reakcji jest zależna od warunków, w których została wyznaczana – jest zmienna w zmiennej temperaturze i ciśnieniu. Wyprowadzenie wzoru należy zacząć od definicji pojemności cieplnej, czyli stosunku dostarczonego ciepła do przyrostu temperatury:
![]()
Przy założeniu warunków izotermicznych, można go przekształcić:
![]()
Scałkowanie otrzymanego równania oraz zamiana pojemności cieplnej na człon odpowiadający zmianie standardowej pojemności cieplnej, odzwierciedla równanie prawa Kirchhoffa:
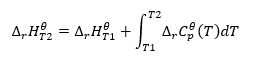
Dla warunków standardowych, zmianę pojemności cieplnej reakcji opisuje równanie, ze zmiennymi v, czyli współczynnikami stechiometrycznymi oraz , oznaczającym standardowe ciepło molowe danego reagenta. W przypadku kiedy występuje niewielka różnica temperatur (do 100K), wartość standardowego ciepła molowego reagenta przyjmuje się jako stałe w danym zakresie. Możliwe jest wtedy zastosowanie uproszczonej formy prawa Kirchhoffa, przy założeniu, że pojemności cieplne reagentów nie zależą od temperatury, a pod stałym ciśnieniem, :
![]()
