L'energia delle reazioni chimiche è uno degli elementi importanti che ci permettono di comprendere le trasformazioni che avvengono in una reazione chimica. Durante tale trasformazione vengono prodotti composti chimici con struttura e composizione chimica diverse da quelle delle materie prime di cui sono costituiti. Nel corso di una reazione chimica si rompono i legami esistenti tra gli atomi delle molecole utilizzate come reagenti e si formano nuovi legami presenti nei prodotti.

Il sistema e l’ambiente di una reazione chimica
Per la corretta interpretazione di una reazione chimica in termini di energia, dobbiamo avere una certa conoscenza di quanto segue:
- Sistema: un’area separata di materia con confini chiari. La tipologia del sistema è importante: è aperto se la reazione prevede lo scambio di energia e materia, chiuso se la reazione prevede solo scambio di energia, oppure isolato se non viene scambiato né energia né materia.
- Ambiente: tutto ciò che non è incluso nel sistema ma si trova nelle vicinanze.
- Componenti del sistema: tutte le sostanze che si trovano nel sistema analizzato e hanno le loro proprietà chimiche caratteristiche.
L’energia dei legami chimici
L’effetto energetico che caratterizza ogni reazione chimica è il risultato di cambiamenti che avvengono durante la rottura e la produzione di nuovi legami tra gli atomi. Il fatto è che ogni rottura di un legame chimico è intrinsecamente legata all’assorbimento di un’opportuna quantità di energia, mentre la formazione di un nuovo legame provoca la produzione di energia. Il rilascio di energia nell’ambiente può avere diversi effetti: calore, luce, lavoro o elettricità. Ciascuno di questi processi è un fattore componente che influenza il cambiamento generale dell’energia interna del sistema in cui avviene la reazione. È importante che, indipendentemente dal fatto che i reagenti debbano assorbire o cedere energia durante la trasformazione, sia sempre necessaria una certa quantità di energia per avviare l’intero processo.
La prima legge della termodinamica
La prima regola importante riguardante l’energia delle reazioni chimiche è la relazione formulata nella prima legge della termodinamica, secondo la quale l’energia interna di un sistema che scambia solo energia con l’ambiente (un sistema chiuso) può essere trasformata solo in calore o lavoro. Ciò si riflette nell’equazione di Helmholtz: ∆U = Q + W Dove ΔU denota la variazione di energia interna, Q denota calore e W denota lavoro. Possiamo notare dalla formula che l’energia interna di un sistema isolato, cioè che non scambia energia o massa con l’ambiente, è costante. I componenti dell’energia interna sono tutte le energie cinetiche di atomi, ioni, molecole, elettroni e componenti del nucleo atomico, che sono attualmente nel sistema di reazione, così come le energie delle loro interazioni, cioè le energie dei legami chimici, interazioni tra le cariche e così via. Si noti che l’energia interna non contiene energia cinetica o potenziale del sistema nel suo complesso. La somma delle energie cinetiche e potenziali del sistema nel suo insieme e dell’energia interna è l’energia totale del sistema (E).
Entalpia del sistema (H)
Questo è un altro importante concetto legato all’energia delle reazioni chimiche, che in pratica significa la somma dell’energia interna del sistema e il prodotto della sua pressione e del suo volume. In termini qualitativi, è l’energia necessaria per produrre un sistema nel vuoto (U), aumentata del lavoro, cioè del quoziente di pressione e volume (pV), che il sistema deve svolgere contro le forze esterne per raggiungere un volume diverso da zero. La relazione che definisce l’entalpia di un sistema è espressa come segue: H = U + pV Una reazione che avviene in un tale sistema provoca una variazione infinitamente piccola dell’entalpia: dH = dU + dpV + pdV Se le condizioni di reazione sono isobariche, quindi se la pressione durante il processo non cambia, la seconda parte può essere omessa, perché dpV=0. Dopo aver sostituito ai differenziali gli incrementi definiti e dopo aver sostituito l’espressione riferita alla variazione dell’energia interna del sistema, si ottiene la seguente relazione: ∆H = Q + W + p∆V Assumendo che il processo analizzato compia un lavoro volumetrico a pressione costante , quindi W = -pΔV, e di conseguenza: ∆H = Q – p∆V + p∆V Dall’equazione segue che se la reazione avviene a pressione costante, allora la variazione dell’entalpia del sistema è pari al calore: ΔH = Q
Capacità energetiche di una reazione
Sulla base della formula sopra derivata, che indica che la variazione dell’entalpia del sistema può essere uguale al calore della reazione, i processi vengono classificati in base alle trasformazioni termiche. In termini di direzione del flusso di energia, dividiamo le reazioni chimiche in:
- Reazioni esotermiche, che sono tali reazioni in cui possiamo osservare l’emissione di energia, ad esempio sotto forma di calore, nell’ambiente del sistema. Questo accade quando la somma delle entalpie dei prodotti è minore della somma delle entalpie dei substrati, quindi quando ΔH<0.
- Reazioni endotermiche, quindi reazioni chimiche che provocano l’assorbimento di energia dall’ambiente. Una condizione per una tale reazione è fornire una quantità appropriata di quell’energia. Questo vale per tutte le trasformazioni per le quali l’entalpia totale dei prodotti è maggiore dell’entalpia totale dei substrati, quindi ΔH>0.
Notazioni di reazioni chimiche
Considerando le reazioni chimiche insieme alla loro domanda e distribuzione di energia, i loro effetti termici specifici sono inclusi nella notazione di un’equazione chimica. Per le reazioni esotermiche, il valore assoluto dell’effetto termico esistente è annotato sul lato del prodotto. Viceversa, quando si annota una reazione endotermica, si annota dal lato del substrato il valore assoluto dell’energia assorbita. Per fare un esempio:
- Reazione esotermica:
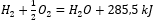
- Reazione endotermica: 2H 3 PO 4 + 3Mg(OH) 2 + 407kJ = Mg 3 (PO 4 ) 2 + 6H 2 O
Un altro modo è annotare un’equazione chimica insieme al valore dell’effetto energetico dato a parte. In questo caso il valore che rappresenta l’energia di una reazione esoenergica è negativo, mentre è positivo per una reazione endoenergica. Per esempio:
- Reazione esoenergica: Fe + S → FeS ∆H= -95,2 kJ/mol
- Reazione endoenergica: FeS → Fe + S ∆H= 95,2 kJ/mol
La legge di Hess
Costituisce una base per i calcoli termochimici, affermando che l’effetto del calore è sempre lo stesso indipendentemente dal modo in cui viene eseguita la reazione. Questo ci permette di calcolare l’entalpia standard di una reazione (Δ r H ϴ ), assumendo l’utilizzo di condizioni standard, cioè una pressione di 10 5 Pa e qualsiasi temperatura. Poiché l’entalpia è una funzione di stato, la sua variabilità dipende solo da due valori: negli stati iniziale e finale, che in una reazione chimica rappresentano rispettivamente lo stato dei substrati e lo stato dei prodotti. La legge di Hess è espressa da un’equazione che contiene coefficienti stechiometrici (v) ed entalpie molari standard di formazione (Δ f H ϴ ): 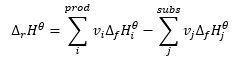
Entalpia molare standard di formazione
È un’entalpia ottenuta formando 1 mole di un particolare composto chimico da elementi nei loro stati basici. Lo stato di base è la variante più duratura dell’elemento in condizioni specifiche. Per fare un esempio, la grafite è la variante più duratura del carbonio a 25 o C e 10 5 Pa. Al contrario, ad alta temperatura e pressione, una forma stabile di carbonio è il diamante. Per ogni reagente che partecipa a una reazione nella sua condizione di base, il valore dell’entalpia molare standard di formazione è zero. Di solito si tratta di singoli atomi di gas nobili o delle varianti più durevoli di altri gas in condizioni specifiche. Per una pressione (10 5 Pa) e una temperatura standard (normalmente 25 o C), i valori delle entalpie molari standard di formazione dei composti sono raccolti in tabelle chimiche. L’unità di tale valore è . La legge di Hess applicata alle reazioni chimiche implica che il valore di entalpia della reazione è indipendente dal numero di reazioni intermedie. L’unica informazione chiave è che vengono utilizzati substrati particolari per ottenere prodotti particolari.
La sintesi dell’anidride carbonica
La sintesi dell’anidride carbonica può essere effettuata in vari modi, ma secondo la legge di Hess ognuno di essi porta allo stesso valore di variazione delle entalpie standard.
- Sintesi diretta
- La sintesi di ossido di carbonio (II) + ossidazione del composto ad ossido di carbonio (IV).
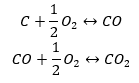 Quando leggiamo i valori delle entalpie standard di formazione dei composti dalla tabella e li sostituiamo nelle equazioni chimiche, vedremo che l’entalpia per ogni metodo è la stessa: -393,5 kJ/mol.
Quando leggiamo i valori delle entalpie standard di formazione dei composti dalla tabella e li sostituiamo nelle equazioni chimiche, vedremo che l’entalpia per ogni metodo è la stessa: -393,5 kJ/mol.
Legge di Kirchhoff
Ci permette di trasformare i calcoli per calcolare l’entalpia standard di una reazione per una certa temperatura, se conosciamo il suo valore a una temperatura diversa. Conosciamo anche le relazioni tra il calore molare di tutti i reagenti e la temperatura. La legge può essere applicata, in quanto la variazione dell’entalpia della reazione dipende dalle condizioni in cui è stata determinata: varia al variare della temperatura e della pressione. La derivazione della formula dovrebbe iniziare definendo la capacità termica, cioè il rapporto tra il calore fornito e l’aumento della temperatura: ![]() Assumendo condizioni isoterme, possiamo effettuare la seguente trasformazione:
Assumendo condizioni isoterme, possiamo effettuare la seguente trasformazione: ![]() L’integrazione dell’equazione risultante e la conversione della capacità termica nella parte che rappresenta la variazione della capacità termica standard è riflessa dall’equazione fornita dalla legge di Kirchhoff:
L’integrazione dell’equazione risultante e la conversione della capacità termica nella parte che rappresenta la variazione della capacità termica standard è riflessa dall’equazione fornita dalla legge di Kirchhoff: 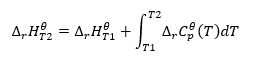 Per condizioni standard, la variazione della capacità termica di una reazione è definita dall’equazione con v-variabili, essendo fattori stechiometrici, e , che rappresenta il calore molare standard di un dato reagente. Quando la differenza di temperatura è piccola (fino a 100 K), si presume che il valore del calore molare standard del reagente sia costante entro un certo intervallo. Allora possiamo usare la forma semplificata della legge di Kirchhoff, supponendo che le capacità termiche dei reagenti non dipendano dalla temperatura ma dalla pressione costante, :
Per condizioni standard, la variazione della capacità termica di una reazione è definita dall’equazione con v-variabili, essendo fattori stechiometrici, e , che rappresenta il calore molare standard di un dato reagente. Quando la differenza di temperatura è piccola (fino a 100 K), si presume che il valore del calore molare standard del reagente sia costante entro un certo intervallo. Allora possiamo usare la forma semplificata della legge di Kirchhoff, supponendo che le capacità termiche dei reagenti non dipendano dalla temperatura ma dalla pressione costante, : ![]()

