Tenaga tindak balas kimia adalah salah satu unsur penting yang membolehkan kita memahami perubahan yang berlaku dalam tindak balas kimia. Semasa transformasi sedemikian, sebatian kimia dihasilkan dengan struktur dan komposisi kimia yang berbeza daripada bahan mentah yang diperbuat daripadanya. Dalam perjalanan tindak balas kimia, ikatan yang wujud di antara atom-atom molekul yang digunakan sebagai bahan tindak balas diputuskan dan ikatan baru dihasilkan - terdapat dalam produk.

Sistem dan persekitaran tindak balas kimia
Untuk tafsiran yang betul tentang tindak balas kimia dari segi tenaga, kita perlu mempunyai pengetahuan tentang perkara berikut:
- Sistem: kawasan jirim yang terpisah dengan sempadan yang jelas. Jenis sistem adalah penting: ia terbuka jika tindak balas melibatkan pertukaran tenaga dan jirim, tertutup jika tindak balas hanya melibatkan pertukaran tenaga, atau diasingkan jika tiada tenaga atau jirim ditukar.
- Persekitaran: apa-apa yang tidak termasuk dalam sistem tetapi terletak berdekatan.
- Komponen sistem: semua bahan yang terdapat dalam sistem yang dianalisis dan mempunyai sifat kimia cirinya.
Tenaga ikatan kimia
Kesan tenaga yang mencirikan sebarang tindak balas kimia adalah hasil daripada perubahan yang berlaku semasa terputus dan menghasilkan ikatan baru antara atom. Hakikatnya ialah setiap pemecahan ikatan kimia secara intrinsik dikaitkan dengan penyerapan jumlah tenaga yang sesuai, manakala pembentukan ikatan baru menyebabkan pengeluaran tenaga. Pembebasan tenaga kepada alam sekitar boleh mempunyai kesan yang berbeza: haba, cahaya, kerja atau elektrik. Setiap proses ini adalah faktor komponen yang mempengaruhi perubahan umum dalam tenaga dalaman sistem di mana tindak balas berlaku. Adalah penting bahawa, tidak kira sama ada reagen mesti menarik atau melepaskan tenaga semasa transformasi, sejumlah tenaga tertentu sentiasa diperlukan untuk memulakan keseluruhan proses.
Hukum pertama termodinamik
Peraturan penting pertama mengenai tenaga tindak balas kimia ialah hubungan yang dirumuskan dalam undang-undang pertama termodinamik, menyatakan bahawa tenaga dalaman sistem yang hanya menukar tenaga dengan persekitaran (sistem tertutup) hanya boleh diubah menjadi haba atau kerja. Ini ditunjukkan dalam persamaan Helmholtz: ∆U = Q + W Di mana ΔU menandakan perubahan tenaga dalaman, Q menandakan haba, dan W menandakan kerja. Kita boleh perhatikan daripada formula bahawa tenaga dalaman sistem terpencil, iaitu, yang tidak menukar tenaga atau jisim dengan persekitaran, adalah malar. Komponen tenaga dalaman ialah semua tenaga kinetik atom, ion, molekul, elektron, dan komponen nukleus atom, yang kini berada dalam sistem tindak balas, serta tenaga interaksinya, iaitu tenaga ikatan kimia, interaksi. antara pertuduhan, dan sebagainya. Sila ambil perhatian bahawa tenaga dalaman tidak mengandungi tenaga kinetik atau potensi sistem secara keseluruhan. Jumlah tenaga kinetik dan potensi sistem secara keseluruhan dan tenaga dalaman ialah jumlah tenaga sistem (E).
Entalpi sistem (H)
Ini adalah satu lagi konsep penting yang berkaitan dengan tenaga tindak balas kimia, yang secara praktikalnya bermaksud jumlah tenaga dalaman sistem dan hasil tekanan dan isipadunya. Dari segi kualitatif, ia adalah tenaga yang diperlukan untuk menghasilkan sistem dalam vakum (U), meningkat dengan kerja, iaitu hasil bagi tekanan dan isipadu (pV), yang sistem mesti lakukan terhadap daya luar untuk mencapai isipadu yang berbeza daripada sifar. Hubungan yang mentakrifkan entalpi sistem dinyatakan seperti berikut: H = U + pV Tindak balas yang berlaku dalam sistem sedemikian menyebabkan perubahan entalpi yang sangat kecil: dH = dU + dpV + pdV Jika keadaan tindak balas adalah isobarik, jadi jika tekanan semasa proses tidak berubah, bahagian kedua boleh ditinggalkan, kerana dpV=0. Selepas menggantikan pembezaan untuk kenaikan yang pasti dan selepas menggantikan ungkapan yang merujuk kepada perubahan tenaga dalaman sistem, kita memperoleh hubungan berikut: ∆H = Q + W + p∆V Dengan mengandaikan bahawa proses yang dianalisis melakukan kerja isipadu pada tekanan malar , kemudian W = -pΔV, dan akibatnya: ∆H = Q – p∆V + p∆V Ia mengikuti daripada persamaan bahawa jika tindak balas berlaku pada tekanan malar, maka perubahan dalam entalpi sistem adalah sama dengan haba: ∆H = Q
Keupayaan bertenaga sesuatu tindak balas
Berdasarkan formula yang diperolehi di atas, yang menunjukkan bahawa perubahan dalam entalpi sistem mungkin sama dengan haba tindak balas, proses dikelaskan mengikut transformasi haba. Dari segi arah aliran tenaga, kami membahagikan tindak balas kimia kepada:
- Tindak balas eksotermik, iaitu tindak balas sedemikian di mana kita boleh memerhatikan pelepasan tenaga, contohnya dalam bentuk haba, kepada persekitaran sistem. Ini berlaku apabila jumlah entalpi produk lebih rendah daripada jumlah entalpi substrat, jadi apabila ΔH<0.
- Tindak balas endotermik, jadi tindak balas kimia sedemikian yang menyebabkan penyerapan tenaga daripada persekitaran. Syarat untuk tindak balas sedemikian adalah untuk menyampaikan jumlah tenaga yang sesuai. Ini terpakai kepada semua transformasi yang mana jumlah entalpi produk lebih tinggi daripada jumlah entalpi substrat, jadi ΔH>0.
Notasi tindak balas kimia
Memandangkan tindak balas kimia bersama-sama dengan permintaan tenaga dan pengedarannya, kesan haba spesifiknya dimasukkan dalam tatatanda persamaan kimia. Untuk tindak balas eksotermik, nilai mutlak kesan haba sedia ada dicatatkan pada bahagian produk. Sebaliknya, apabila mencatatkan tindak balas endotermik, nilai mutlak tenaga yang diserap dicatatkan pada bahagian substrat. Untuk memberi contoh:
- Tindak balas eksotermik:
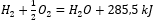
- Tindak balas endotermik: 2H 3 PO 4 + 3Mg(OH) 2 + 407kJ = Mg 3 (PO 4 ) 2 + 6H 2 O
Cara lain ialah mencatat persamaan kimia bersama-sama dengan nilai kesan tenaga yang diketepikan. Dalam kes ini, nilai yang mewakili tenaga tindak balas eksoenergik adalah negatif, manakala ia positif untuk tindak balas endoenergik. Sebagai contoh:
- Tindak balas eksoenergik: Fe + S → FeS ∆H= -95,2 kJ/mol
- Tindak balas endoenergik: FeS → Fe + S ∆H= 95,2 kJ/mol
Undang-undang Hess
Ia membentuk asas untuk pengiraan termokimia, menyatakan bahawa kesan haba sentiasa sama tanpa mengira cara tindak balas dijalankan. Ini membolehkan kita mengira entalpi piawai tindak balas (Δ r H ϴ ), dengan mengandaikan penggunaan keadaan piawai, iaitu tekanan 10 5 Pa dan sebarang suhu. Oleh kerana entalpi ialah fungsi keadaan, kebolehubahannya bergantung kepada hanya dua nilai: dalam keadaan awal dan akhir, yang dalam tindak balas kimia mewakili keadaan substrat dan keadaan produk, masing-masing. Hukum Hess dinyatakan dengan persamaan yang mengandungi pekali stekiometrik (v) dan entalpi pembentukan molar piawai (Δ f H ϴ ): 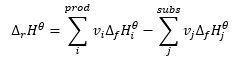
Entalpi pembentukan molar piawai
Ia adalah entalpi yang diperoleh dengan membentuk 1 mol sebatian kimia tertentu daripada unsur-unsur dalam keadaan asasnya. Keadaan asas ialah varian unsur yang paling tahan lama dalam keadaan tertentu. Sebagai contoh, grafit ialah varian karbon yang paling tahan lama pada 25 o C dan 10 5 Pa. Sebaliknya, pada suhu dan tekanan tinggi, bentuk karbon yang stabil ialah berlian. Bagi setiap bahan tindak balas yang mengambil bahagian dalam tindak balas dalam keadaan asasnya, nilai entalpi pembentukan molar piawai adalah sifar. Biasanya ini adalah atom individu gas mulia atau varian gas lain yang paling tahan lama dalam keadaan tertentu. Untuk tekanan piawai (10 5 Pa) dan suhu (biasanya 25 o C), nilai entalpi molar piawai pembentukan sebatian dikumpulkan dalam jadual kimia. Unit bagi nilai itu ialah . Hukum Hess digunakan untuk tindak balas kimia membayangkan bahawa nilai entalpi tindak balas adalah bebas daripada bilangan tindak balas perantaraan. Satu-satunya maklumat penting ialah substrat tertentu digunakan untuk mendapatkan produk tertentu.
Sintesis karbon dioksida
Sintesis karbon dioksida boleh dilakukan dalam pelbagai cara, tetapi mengikut hukum Hess setiap daripada mereka membawa kepada nilai perubahan yang sama dalam entalpi piawai.
- Sintesis langsung
- Sintesis karbon (II) oksida + pengoksidaan sebatian kepada karbon (IV) oksida
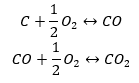 Apabila kita membaca nilai entalpi piawai pembentukan sebatian daripada jadual dan menggantikannya dalam persamaan kimia, kita akan melihat bahawa entalpi bagi setiap kaedah adalah sama: -393.5 kJ/mol.
Apabila kita membaca nilai entalpi piawai pembentukan sebatian daripada jadual dan menggantikannya dalam persamaan kimia, kita akan melihat bahawa entalpi bagi setiap kaedah adalah sama: -393.5 kJ/mol.
undang-undang Kirchhoff
Ia membolehkan kita mengubah pengiraan untuk mengira entalpi piawai tindak balas untuk suhu tertentu, jika kita mengetahui nilainya pada suhu yang berbeza. Kami juga mengetahui hubungan antara haba molar semua bahan tindak balas dan suhu. Undang-undang boleh digunakan, kerana perubahan dalam entalpi tindak balas bergantung pada keadaan di mana ia ditentukan: ia berbeza-beza seiring dengan perubahan suhu dan tekanan. Terbitan formula hendaklah dimulakan dengan mentakrifkan kapasiti haba, iaitu nisbah haba yang dibekalkan kepada kenaikan suhu: ![]() Dengan mengandaikan keadaan isoterma, kita boleh membuat transformasi berikut:
Dengan mengandaikan keadaan isoterma, kita boleh membuat transformasi berikut: ![]() Penyepaduan persamaan yang terhasil dan penukaran kapasiti haba ke bahagian yang mewakili perubahan kapasiti haba piawai dicerminkan oleh persamaan yang disediakan oleh undang-undang Kirchhoff:
Penyepaduan persamaan yang terhasil dan penukaran kapasiti haba ke bahagian yang mewakili perubahan kapasiti haba piawai dicerminkan oleh persamaan yang disediakan oleh undang-undang Kirchhoff: 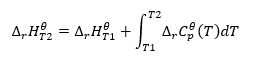 Untuk keadaan piawai, perubahan dalam kapasiti terma tindak balas ditakrifkan oleh persamaan dengan pembolehubah v, sebagai faktor stekiometri, dan , yang mewakili haba molar piawai bagi bahan tindak balas tertentu. Apabila perbezaan suhu kecil (sehingga 100K), nilai haba molar piawai bahan tindak balas diandaikan malar dalam julat tertentu. Kemudian kita boleh menggunakan bentuk ringkas hukum Kirchhoff, dengan mengandaikan bahawa kapasiti terma bahan tindak balas tidak bergantung pada suhu tetapi pada tekanan malar, :
Untuk keadaan piawai, perubahan dalam kapasiti terma tindak balas ditakrifkan oleh persamaan dengan pembolehubah v, sebagai faktor stekiometri, dan , yang mewakili haba molar piawai bagi bahan tindak balas tertentu. Apabila perbezaan suhu kecil (sehingga 100K), nilai haba molar piawai bahan tindak balas diandaikan malar dalam julat tertentu. Kemudian kita boleh menggunakan bentuk ringkas hukum Kirchhoff, dengan mengandaikan bahawa kapasiti terma bahan tindak balas tidak bergantung pada suhu tetapi pada tekanan malar, : ![]()

