Это микроскопические скопления молекул, характеризующиеся сферической структурой. Они представляют собой широко используемую и очень эффективную группу поверхностно-активных веществ, то есть сурфактантов. Благодаря своим уникальным свойствам они играют очень важную роль во многих областях промышленности, в том числе в косметологии.

Благодаря своей структуре мицеллы практически поглощают все виды загрязнений с обрабатываемой поверхности. Чаще всего о мицеллах говорят в контексте косметических средств для очищения лица, однако они также входят в состав таких продуктов, как моющие средства для стирки или средства для мытья посуды. Мицеллярные растворы характеризуются способностью растворять труднорастворимые соединения, что является определением процесса солюбилизации.
Строение и свойства мицелл
Строение мицелл определяет их уникальные физико-химические свойства. В этой части мы рассмотрим, как образуются мицеллы, из чего они состоят и какие процессы определяют их поведение в растворах.
Глазами химика
Мицеллы — это не что иное, как ассоциативные коллоиды, образованные в результате процесса мицеллизации. Таким процессом мы называем превращение молекул или ионов амфифильного характера, которые в результате растворения подвергаются самоассоциации в более крупные скопления.
Таким образом, мицеллы не являются конкретной группой химических соединений, а скорее специфической формой организации их молекул. Такое самопроизвольное преобразование, приводящее к образованию мицелл, характерно для различных органических веществ, молекулы которых состоят из двух частей, значительно различающихся по полярности.
Когда содержание поверхностно-активных (ПАВ) веществ в растворе увеличивается, при определенной концентрации ассоциатов начинают образовываться именно такие характерные структуры. Точка начала таких превращений называется концентрацией CMC.
Что означает аббревиатура CMC?
CMC, или критическая концентрация мицеллообразования (англ. critical micellization concentration), — это концентрация, при которой начинается образование мицелл в результате самоассоциации накопленных мономеров в более крупные агрегаты ( ). Такое образование скоплений молекул сопровождается также изменением их физических свойств.
Выше CMC такая группа молекул остается в состоянии равновесия с отдельными молекулами, благодаря чему становится термодинамически устойчивой формой. Это равновесие является ключевым моментом превращения, поскольку может протекать непрерывно в обоих направлениях. Например, при разбавлении мицеллы вновь распадаются. Ниже концентрации CNC молекулы поверхностно-активных веществ свободно перемещаются в растворе, не образуя организованной структуры.
Физические свойства мицелл
С увеличением концентрации поверхностно-активного вещества в растворе происходит изменение:
- поверхностного натяжения,
- Электропроводности,
- Интенсивности рассеяния света,
- Вязкости.
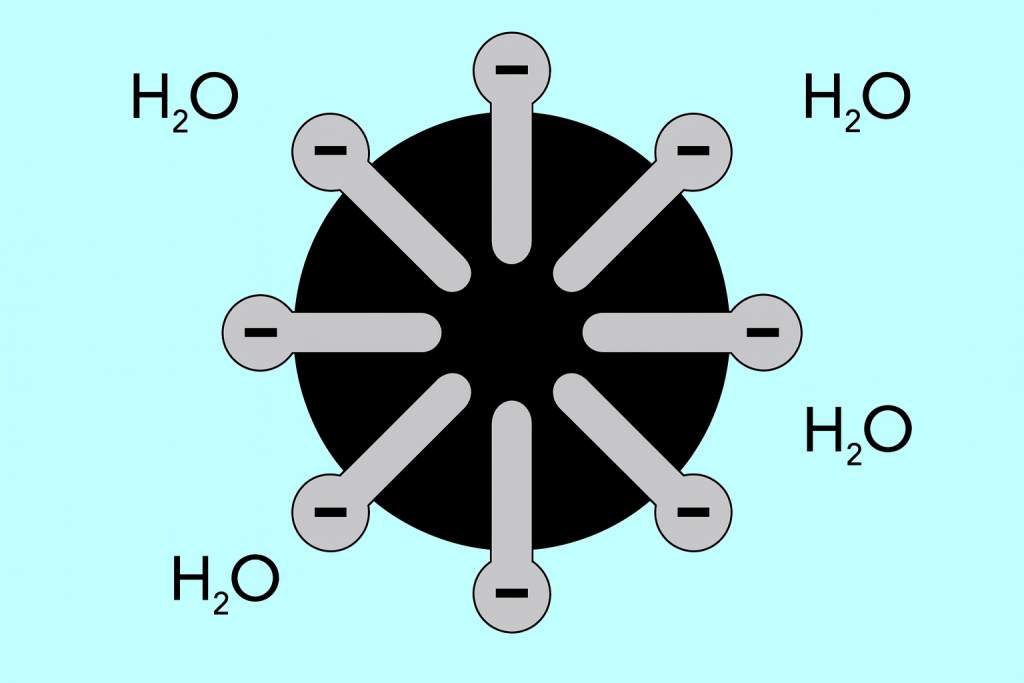
Головка и хвост — строение мицелл
Структуру мицел можно разделить на две основные части, которые значительно отличаются друг от друга полярностью и называются:
- Гидрофильной головкой, которая обладает высокой afinностью к воде. Она является частью мицеллы, которая отвечает за склонность частиц к соединению с водой, но и отталкиванию от жиров.
- Гидрофобный хвост, иначе называемый липофильным, который действует противоположным образом — притягивает частицы к жирам и отталкивает от воды.
Гидрофобная область чаще всего представляет собой гидрокарбонатные цепи, радикалы:
- алкильные,
- алкиларильные,
- фторированные углеводородные.
Гидрофильную область составляют группы, которые характеризуются достаточно сильным взаимодействием с водой, например, ионогенные группы. Также неионогенные группы, такие как эфирные, могут составлять гидрофильную часть мицелл, однако обычно это требует наличия большего количества полярных групп в молекуле.
Процесс мицеллизации
В связи с тем, что неполярная часть вещества, например алкильная цепь отдельной рассеянной молекулы поверхностно-активного вещества, имеет большую площадь соприкосновения с водой, а взаимодействие между несколькими молекулами воды значительно сильнее, чем их взаимодействие с группами –CH2 , происходит уменьшение энтропии системы и начинается упорядочение молекул воды в месте алкильной цепи.
Это приводит к своеобразному вытеснению углеводородных цепей из внутренней части водной фазы. С увеличением концентрации поверхностно-активного вещества увеличивается также количество столкновений между ними. Это также приводит к увеличению вероятности агрегации и уплотнения молекул.
Уплотнение молекул сопровождается уменьшением свободной энтальпии. Это также является результатом соединения неполярных остатков с неполярным ядром в жидком состоянии, которое отделяется от водной фазы группами полярного характера.
После достижения вышеупомянутой концентрации CMC, то есть критической концентрации образования мицелл, накапливаются шарообразные скопления, в которых полярные группы отдельных частиц направлены к водной фазе, а неполярные углеводородные цепи образуют внутреннюю часть. Полученные таким образом мицеллы называются нормальными.
В органических растворителях могут встречаться обратные мицеллы, в которых снаружи находится гидрофобная часть.

Типы и примеры поверхностно-активных веществ
Тип поверхностно-активных веществ, используемых для образования мицелл, оказывает огромное влияние на их структуру и функциональность. Ниже приведены наиболее распространенные типы и примеры поверхностно-активных соединений, которые образуют мицеллы
Примеры поверхностно-активных ионов
Ионы с отрицательным зарядом, катионы:
- карбоксильные,
- сульфатные,
- сульфонатные,
- фосфатные.
Ионы с положительным зарядом, катионы:
- аммониевые,
- фосфониевые.
Типы поверхностно-активных веществ
- Ионные поверхностно-активные вещества
- Анионные, например SDS, то есть додецилсульфат натрия,
- Катионные, например CTAB, то есть цетилтриметиламмоний бромид,
- Амфионы, то есть ионы, называемые амбиполярными или биполярными, которые имеют как положительно заряженную катионную группу, так и отрицательно заряженную анионную группу, например, лецитин, то есть фосфатидилхолин.
- Неионогенные поверхностно-активные вещества, например, полиоксиэтилены.
Поверхностная активность поверхностно-активных веществ и структура мицелл
Этот параметр, характерный для поверхностно-активных веществ, увеличивается с ростом числа метиленовых групп, присутствующих в гидрокарбонатной цепи.
В зависимости от структуры цепи мицеллы можно разделить на:
- Одноцепочечные
- Анионные, например SDS,
- Катионные, например CTAB.
- Двухцепочечныe
- Анионные, например, AOT, то есть бис(2-этилгексил)-янтарная кислота сульфонат натрия,
- Катионные, например, дигексадецилдиметиламмоний бромид.
- Молекулярные, например MGDG, то есть моногалактозил-диглицерид.

Применение мицелл
Мицеллы имеют широкое применение — от косметологии до фармацевтики и химической промышленности. Ознакомьтесь с основными областями, в которых их свойства используются на практике.
Эффективное очищение кожи
Возможно благодаря наличию как липофильных, так и гидрофильных частиц. Например, в косметических средствах для снятия макияжа, содержащих мицеллярную воду, гидрофобные частицы связываются с присутствующим на коже себумом и остатками макияжа, а гидрофильные частицы притягивают оседающую на ней пыль и загрязнения. Это приводит к двойному очищению, благодаря чему возможно эффективное и глубокое очищение без ненужного высушивания и раздражения.
Мицеллярные продукты рекомендуются даже для чувствительной кожи благодаря своему мягкому действию. При их использовании не нужно тереть или сильно давить ватными дисками, а действие этих коллоидов сравнивают с магнием на грязь. Водные растворы с мицеллами не нарушают гидролипидный слой эпидермиса.
Формула мицеллярных косметических средств
Преимуществом таких маленьких частиц, как мицеллы, является также отсутствие ограничений в отношении составов, в которых они используются. Их можно использовать в самой популярной форме – мицеллярной воде, а также в кремах или бальзамах.
Также создаются сильно сконденсированные гелевые формулы, которые не требуют использования полотенец или косметических дисков, а только втирания в кожу и смывания водой.
Трехэтапное действие мицелл
- Притяжение загрязнений благодаря гидрофобным хвостам,
- Инкапсуляция, которая приводит к закрытию внутри мицел молекул жира и грязи,
- Удаление загрязнений, захваченных мицеллами, с помощью гидрофильных головок, остающихся в контакте с водной фазой.
Другие применения мицелл в промышленности
- Косметология, в основном мицеллярные жидкости и бальзамы для снятия макияжа, но также мицеллярные шампуни для глубокого очищения кожи головы, гели для душа.
- Фармацевтика, например, для повышения усвояемости активных веществ путем введения в организм лекарственных средств с ограниченной растворимостью в виде неионогенных мицелярных растворов.
- Чистящие средства — упомянутый процесс солюбилизации объясняет физико-химию стирки. Мицеллярные коллоиды в виде растворов вызывают окружение жира, отделение загрязнений и их отделение от ткани. При использовании ионных поверхностно-активных веществ частицы загрязнений и поверхность, к которой они прилипают, приобретают одинаковый заряд, благодаря чему они легко отделяются друг от друга.
- Физические и химические процессы: мицеллярная катализа, ингибирование химических реакций, флотация и процессы извлечения нефти.
- Witek K. Synteza, właściwości powierzchniowe i zastosowanie surfaktantów amfoterycznych, zawierających ugrupowania labilne, Politechnika Wrocławska 2022
- K.Michocka Otrzymywanie i właściwości użytkowe nowych surfaktantów z ugrupowaniem cukrowym, Uniwersytet Ekonomiczny w Poznaniu 2012
- A.Piotrowska-Kirschling, J.Drzeżdżon, L.Chmurzyński, D.Jacewicz Krytyczne stężenie micelarne i metody jego wyznaczania, Wiadomości chemiczne 2018
- https://wydawnictwo.ue.poznan.pl/books/978-83-8211-090-6/sample.pdf
- https://home.agh.edu.pl/~nmos1/FUK/fizykochemia_powierzchni_skany/15/dutkiewicz_15.pdf
- https://phavi.umcs.pl/at/attachments/2018/0608/143246-chemia-koloidow-cwiczenie-1.pdf





























































































































