การแยกตัวในบริบททางเคมีหมายถึงการสลายตัวของสารเป็นโมเลกุลอื่น คำนี้มาจากคำภาษาละติน " dissociatio " ซึ่งแปลว่า "การแบ่งแยก" ในระบบการตั้งชื่อทางวิทยาศาสตร์ การแยกตัวออกจากกันมีคำจำกัดความที่หลากหลาย เนื่องจากมันมีความหมายเฉพาะในด้านจิตวิทยาด้วย แต่ให้เรามุ่งเน้นไปที่ความหมายของการแยกตัวในวิชาเคมี เราสามารถจำแนกความแตกต่างของการแยกตัวออกเป็นสี่ประเภท ทั้งนี้ขึ้นอยู่กับกระบวนการและสารที่ใช้ ที่นิยมมากที่สุดคือการแยกตัวด้วยไฟฟ้า แม้ว่าการแยกตัวด้วยความร้อนจะมีความสำคัญเท่าเทียมกัน

การแยกตัวด้วยความร้อน
กระบวนการนี้ประกอบด้วยการสลายตัวของโมเลกุลให้เป็นโมเลกุลขนาดเล็กหรือเป็นอะตอมภายใต้อิทธิพลของอุณหภูมิ ความสัมพันธ์ที่สำคัญที่สุดคือข้อเท็จจริงที่ว่าอุณหภูมิที่ใช้ในการแยกตัวอาจต่ำกว่าหากสารประกอบมีพันธะเคมีที่อ่อนกว่า ส่วนที่มีพลังงานสูงซึ่งจำเป็นสำหรับการย่อยสลายนั้นต้องการอุณหภูมิที่สูงกว่า ตัวอย่างทั่วไปของเทอร์โมไลซิส (การแยกตัวด้วยความร้อน) คือ คาราเมลของซูโครส ซึ่งเกิดขึ้นที่อุณหภูมิ 160 o C
การแยกตัวด้วยไฟฟ้า
ค้นพบในปี 1887 โดยนักเคมีชาวสวีเดน Svante Arrhenius ค่อนข้างซับซ้อนกว่าเมื่อเทียบกับการแยกตัวด้วยความร้อน การแยกตัวด้วยไฟฟ้าประกอบด้วยการสลายตัวของสาร ซึ่งเกิดขึ้นเมื่อตัวทำละลาย (โดยปกติคือน้ำ) กระทบกับไอออนที่เคลื่อนที่อย่างอิสระ Arrhenius ได้พิสูจน์ในงานวิจัยของเขาว่าไอออนที่เกิดจากการแยกตัวดังกล่าวทำให้สารละลายนำไฟฟ้าได้ นี่เป็นรากฐานในการพัฒนาการจำแนกประเภทของสารเคมีออกเป็นอิเล็กโทรไลต์ (สารละลายที่สามารถนำกระแสไฟฟ้าได้) และที่ไม่ใช่อิเล็กโทรไลต์ (สารละลายที่ไม่สามารถนำกระแสไฟฟ้าได้)
อิเล็กโทรไลต์
คำว่า “อิเล็กโทรไลต์” มีความหมายสองประการ จากมุมมองทางเทคนิค อิเล็กโทรไลต์คือสารใดๆ ที่สามารถถ่ายเทประจุไฟฟ้าระหว่างอิเล็กโทรดได้ เป็นผลให้มันอาจนำกระแสไฟฟ้าได้ อีกความหมายทางเคมีของคำนั้นหมายถึงสารที่ผ่านการแยกตัวด้วยไฟฟ้าอันเป็นผลมาจากการหลอมหรือการละลาย สารละลายดังกล่าว (ส่วนใหญ่มักจะเป็นน้ำ) นำไฟฟ้าได้เช่นกัน ตัวอย่างของอิเล็กโทรไลต์ดังกล่าวรวมถึงสารประกอบไอออนิก เช่น โซเดียมคลอไรด์ (เกลือแกง) แต่ยังรวมถึงสารประกอบที่ไม่ใช่ไอออนิกด้วย เช่น กรดไฮโดรคลอริก หรือ โพแทสเซียมไฮดรอกไซด์ ด้วยคุณสมบัติเฉพาะของอิเล็กโทรไลต์จึงสามารถเรียกว่าตัวนำไฟฟ้าได้ สิ่งเหล่านี้อาจแบ่งออกเป็นตัวนำประเภท 1 (โลหะ โลหะผสม และคาร์บอน) และตัวนำประเภท 2 (สารละลายของเบส กรด และ เกลือ )
กลไกการแยกตัวด้วยไฟฟ้า
ในตัวทำละลายที่มีค่าคงที่ไดอิเล็กตริกสูง (เช่น 81 สำหรับน้ำ) แรงดึงดูดระหว่างไอออนในเครือข่ายผลึกจะลดลงอย่างมาก นี่คือตอนที่ไอออนแตกตัว ซึ่งทำให้สารนั้นละลายและหลั่งไอออนที่เคลื่อนที่อย่างอิสระออกมาในสารละลาย กระบวนการดังกล่าวยังเกิดขึ้นเนื่องจากปฏิสัมพันธ์ระหว่างไอออนและโมเลกุลของน้ำซึ่งเป็นผลมาจากโครงสร้างขั้วของ H 2 O จากข้อมูลของ Nekrasov กลไกการทำงานของน้ำในระหว่างการสลายตัวของอิเล็กโทรไลต์ที่มีโครงสร้างไอออนิกนั้นเริ่มต้นขึ้นโดย ไอออนบวกของสารซึ่งดึงดูดขั้วตรงข้ามของโมเลกุลน้ำ ในขณะเดียวกันก็ผลักไอออนบวกออกไป ขั้วตรงข้ามทำหน้าที่ในลักษณะเดียวกัน และไอออนทั้งสองจะถูกล้อมรอบด้วยโมเลกุลของน้ำที่พวกมันดึงดูดเข้ามา แรงดึงดูดดังกล่าวเกิดขึ้นในทั้งสองทิศทางระหว่างโมเลกุลไดโพลาร์และไอออน ซึ่งทำให้แรงดึงดูดของไอออนในอิเล็กโทรไลต์ต่ำลงมาก ดังนั้น กลไกสามารถแบ่งออกได้เป็นสี่ขั้นตอนหลัก: การเปลี่ยนแปลงของขั้วเป็นโครงสร้างไอออนิก การก่อตัวของโครงสร้างไอออนิก และไฮเดรชันของไอออน การเชื่อมโยงระหว่างไอออนกับตัวทำละลายซึ่งเกิดจากการแตกตัวเรียกว่าโซลเวต ถ้าน้ำเป็นตัวทำละลาย จะเรียกว่าไฮเดรต
เปลือกไฮเดรชั่น
เป็นเปลือกที่ประกอบด้วยโมเลกุลของน้ำที่อยู่ในบริเวณใกล้เคียงกับไอออน โดยมีขั้วตรงข้ามกัน ขั้วที่มีประจุอิสระจะดึงดูดชั้นน้ำเพิ่มเติม จนกว่าแรงดึงดูดของไอออนจะอ่อนกว่าพลังงานการเคลื่อนที่ของโมเลกุลในสารละลาย เปลือกช่วยอำนวยความสะดวกในการสลายตัวของโมเลกุลของอิเล็กโทรไลต์เป็นไอออนบวกและประจุลบ และถือเป็นสิ่งกีดขวางที่ขัดขวางการเชื่อมโยงใหม่ของไอออนเพื่อสร้างโมเลกุล 
การแยกตัวของกรดและเบส: กฎของการกระทำโดยมวล
กรดแก่คือกรดที่แสดงการแยกตัวออกมากในสารละลายที่เป็นน้ำ และกรดอ่อนคือกรดที่แยกตัวออกในระดับเล็กน้อยเท่านั้น หากเราเปรียบเทียบความแรงของกรดต่างๆ เราควรคำนึงถึงปัจจัยบางอย่างด้วย เช่น แนวโน้มของโมเลกุลกรดในการให้โปรตอน หรือความเข้มข้นของสารที่เป็นปัญหา อย่างไรก็ตาม มีค่าทางเคมีที่ไม่ขึ้นกับความเข้มข้น แต่แสดงลักษณะเฉพาะของคุณสมบัติเฉพาะของโมเลกุลได้อย่างยอดเยี่ยม นั่นคือ ค่าคงที่ของการแตกตัว การหาค่าสมการสำหรับค่านั้นควรเริ่มต้นด้วยการเขียนสมการสำหรับการ แยกตัวของกรด ตัวอย่างที่มีโปรตอนเดียว (HX) จะมีลักษณะดังนี้: ![]() หากสารละลายเจือจางและกรดอ่อน เราสามารถใช้กฎของการกระทำโดยมวลได้ ซึ่งแสดงไว้ดังนี้
หากสารละลายเจือจางและกรดอ่อน เราสามารถใช้กฎของการกระทำโดยมวลได้ ซึ่งแสดงไว้ดังนี้ 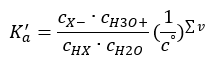 มีสองวิธีในการทำให้ความสัมพันธ์ที่นำเสนอสั้นลง ขั้นตอนแรกคือสมมติว่าความเข้มข้นของน้ำคงที่ เรายังละเว้นสัญลักษณ์ c o ได้ เนื่องจากเป็นการแสดงความเข้มข้นมาตรฐานเท่ากับ 1 โมล/เดซิเมตร 3 อย่างไรก็ตาม สิ่งสำคัญคือต้องวางไว้ในสูตรเริ่มต้นและนำมาพิจารณาเมื่อกำหนดหน่วย เนื่องจากค่าคงที่ทางเคมีเป็นค่าที่ไม่มีมิติ ในขณะเดียวกัน ความเข้มข้นทั้งหมดที่ใช้ในสูตรจะแสดงเป็น mol/dm 3 ในที่สุดเราก็ได้สูตรสำหรับค่าคงที่การแยกตัว:
มีสองวิธีในการทำให้ความสัมพันธ์ที่นำเสนอสั้นลง ขั้นตอนแรกคือสมมติว่าความเข้มข้นของน้ำคงที่ เรายังละเว้นสัญลักษณ์ c o ได้ เนื่องจากเป็นการแสดงความเข้มข้นมาตรฐานเท่ากับ 1 โมล/เดซิเมตร 3 อย่างไรก็ตาม สิ่งสำคัญคือต้องวางไว้ในสูตรเริ่มต้นและนำมาพิจารณาเมื่อกำหนดหน่วย เนื่องจากค่าคงที่ทางเคมีเป็นค่าที่ไม่มีมิติ ในขณะเดียวกัน ความเข้มข้นทั้งหมดที่ใช้ในสูตรจะแสดงเป็น mol/dm 3 ในที่สุดเราก็ได้สูตรสำหรับค่าคงที่การแยกตัว: 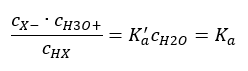 ความสัมพันธ์ที่แสดงค่าคงที่การแยกตัวของกรด (K a ) ประกอบด้วยค่าที่กำหนดโดยการทดลอง ซึ่งอยู่ในช่วง 10 -10 ถึง 10 8 การดำเนินการที่นิยมคือการใช้สูตรลอการิทึม ซึ่งแสดงเป็นลอการิทึมเชิงลบของค่าคงที่การแยกตัว ซึ่งกำหนดเป็น pK a : pK a = -logK a สิ่งสำคัญคือแม้ว่าค่า K a ที่ต่ำจะแสดงถึงกรดอ่อน และค่าที่สูงจะแสดงถึงกรดแก่ , pK a เปลี่ยนแปลงในทางตรงข้าม ค่า pK a ต่ำ โดยปกติจะเป็นค่าลบที่สอดคล้องกับกรดแก่ ค่า a ที่เป็น บวก ค่า pK สูงแสดงถึงกรดอ่อน เมื่อเราแนะนำแนวคิดอื่น ระดับของการแยกตัว (α) ซึ่งเป็นอัตราส่วนของจำนวนโมลของโมเลกุลของสารประกอบที่กำหนดซึ่งผ่านการแตกตัว (การสลายตัวเป็นไอออน) ต่อจำนวนโมลของโมเลกุลของ สารประกอบนั้น อยู่ในสารละลาย เราสามารถพัฒนาสมการต่อไปได้ หากเราไม่คำนึงถึงความเข้มข้นของไอออนไฮโดรเจนที่ต่ำมากที่เกิดจากการแยกตัวของน้ำ และใช้ความเข้มข้นของไอออนและโมเลกุลที่สมดุล เราอาจสันนิษฐานได้ว่า:
ความสัมพันธ์ที่แสดงค่าคงที่การแยกตัวของกรด (K a ) ประกอบด้วยค่าที่กำหนดโดยการทดลอง ซึ่งอยู่ในช่วง 10 -10 ถึง 10 8 การดำเนินการที่นิยมคือการใช้สูตรลอการิทึม ซึ่งแสดงเป็นลอการิทึมเชิงลบของค่าคงที่การแยกตัว ซึ่งกำหนดเป็น pK a : pK a = -logK a สิ่งสำคัญคือแม้ว่าค่า K a ที่ต่ำจะแสดงถึงกรดอ่อน และค่าที่สูงจะแสดงถึงกรดแก่ , pK a เปลี่ยนแปลงในทางตรงข้าม ค่า pK a ต่ำ โดยปกติจะเป็นค่าลบที่สอดคล้องกับกรดแก่ ค่า a ที่เป็น บวก ค่า pK สูงแสดงถึงกรดอ่อน เมื่อเราแนะนำแนวคิดอื่น ระดับของการแยกตัว (α) ซึ่งเป็นอัตราส่วนของจำนวนโมลของโมเลกุลของสารประกอบที่กำหนดซึ่งผ่านการแตกตัว (การสลายตัวเป็นไอออน) ต่อจำนวนโมลของโมเลกุลของ สารประกอบนั้น อยู่ในสารละลาย เราสามารถพัฒนาสมการต่อไปได้ หากเราไม่คำนึงถึงความเข้มข้นของไอออนไฮโดรเจนที่ต่ำมากที่เกิดจากการแยกตัวของน้ำ และใช้ความเข้มข้นของไอออนและโมเลกุลที่สมดุล เราอาจสันนิษฐานได้ว่า: 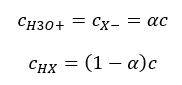 จากนั้นสามารถบันทึกค่าคงที่การแยกตัวได้ดังนี้:
จากนั้นสามารถบันทึกค่าคงที่การแยกตัวได้ดังนี้:  ในรูปแบบนี้เป็นการพึ่งพาระดับการแยกตัวของอิเล็กโทรไลต์จากความเข้มข้น เช่น กฎการเจือจางของ Ostwald หากเราวิเคราะห์อิเล็กโทรไลต์ที่อ่อนแอมาก ระดับของการแยกตัว (α) อาจถือว่า <<1 และสูตรนี้สามารถทำให้ง่ายขึ้นได้ดังต่อไปนี้:
ในรูปแบบนี้เป็นการพึ่งพาระดับการแยกตัวของอิเล็กโทรไลต์จากความเข้มข้น เช่น กฎการเจือจางของ Ostwald หากเราวิเคราะห์อิเล็กโทรไลต์ที่อ่อนแอมาก ระดับของการแยกตัว (α) อาจถือว่า <<1 และสูตรนี้สามารถทำให้ง่ายขึ้นได้ดังต่อไปนี้:  กรดซึ่งมีโปรตอนมากกว่าหนึ่งตัวจะผ่านกระบวนการแยกตัวหลายขั้นตอน และเราต้องคำนึงถึงทุกระยะของโปรตอนด้วย ตัวอย่างเช่น สำหรับกรดออร์โธฟอสฟอริกมีสามขั้นตอน:
กรดซึ่งมีโปรตอนมากกว่าหนึ่งตัวจะผ่านกระบวนการแยกตัวหลายขั้นตอน และเราต้องคำนึงถึงทุกระยะของโปรตอนด้วย ตัวอย่างเช่น สำหรับกรดออร์โธฟอสฟอริกมีสามขั้นตอน:
- H 3 PO 4 + H 2 O = H 2 PO 4 – + H 3 O +
- H 2 PO 4 – + H 2 O = HPO 4 2- + H 3 O +
- HPO 4 2- + H 2 O = PO 4 3- + H 3 O +
แต่ละขั้นมีค่าคงที่สมดุลของตัวเอง ซึ่งสามารถสังเกตได้เหมือนกับขั้นแรก:  ค่าคงที่ของการแตกตัวถูกสร้างเป็นตาราง ทั้งสำหรับกรดไฮดราซิดและกรดออกซิแอซิด
ค่าคงที่ของการแตกตัวถูกสร้างเป็นตาราง ทั้งสำหรับกรดไฮดราซิดและกรดออกซิแอซิด
| กรด | เค เอ | พีเค เอ |
| ฉ | 6,3·10 -4 | 3.2 |
| เอชซีแอล | 1·10 7 | -7 |
| เอชเอ็นโอ 3 | 27.54 น | -1.44 |
| ฮ 3 ป 4 | 6.9·10 -3 | 2.16 |
ตารางที่ 1 ค่าตัวอย่างค่าคงที่การแยกตัวของกรด มันคล้ายกับการรักษาสมดุลของฐานในระหว่างการแยกตัว เมื่อพิจารณาจากตัวอย่างกฎ B สมการสามารถสังเกตได้ดังนี้: ![]() จากนั้น หากเราต้องการหาค่าคงที่การแยกตัวสำหรับฐาน โดยใช้กฎของการกระทำโดยมวล และสมมติว่าความเข้มข้นของน้ำในสารละลายที่เจือจางมีค่าคงที่ เราจะได้สูตรต่อไปนี้:
จากนั้น หากเราต้องการหาค่าคงที่การแยกตัวสำหรับฐาน โดยใช้กฎของการกระทำโดยมวล และสมมติว่าความเข้มข้นของน้ำในสารละลายที่เจือจางมีค่าคงที่ เราจะได้สูตรต่อไปนี้:  ยิ่งฐานแข็งแรง ค่าคงที่การแยกตัวจะยิ่งสูงและค่า pK b ยิ่งต่ำ ในขณะที่ค่าคงที่การแยกตัวยิ่งต่ำและค่า pK b ยิ่งสูง ฐานยิ่งอ่อนลง
ยิ่งฐานแข็งแรง ค่าคงที่การแยกตัวจะยิ่งสูงและค่า pK b ยิ่งต่ำ ในขณะที่ค่าคงที่การแยกตัวยิ่งต่ำและค่า pK b ยิ่งสูง ฐานยิ่งอ่อนลง
| ฐาน | เค บี | พีเค บี |
| ไฮดราซีน | 3·10 -6 | 5.5 |
| แอมโมเนีย | 1.78·10 -5 | 4.75 |
| เมธิลเอมีน | 5.0·10 -4 | 3.3 |
ตารางที่ 2 ตัวอย่างค่าของค่าคงที่การแยกส่วนสำหรับฐาน 
อะไรเป็นตัวกำหนดความแรงของกรด
หากเราทราบนิพจน์ของค่าคงที่การแยกตัวของกรดเฉพาะ เราสามารถตั้งสมมติฐานที่เป็นจริงได้สองสามข้อ:
- ความแข็งแรงของไฮดราซิดจะเพิ่มขึ้นตามจำนวนอะตอมที่เพิ่มขึ้นของธาตุที่เชื่อมโยงกับอะตอมของไฮโดรเจน
- ความแข็งแรงของไฮดราซิดจะลดลงพร้อมกับอิเล็กโทรเนกาติวิตีที่เพิ่มขึ้นของธาตุที่ติดอยู่กับอะตอมของไฮโดรเจน สิ่งนี้อาจทำให้เข้าใจผิดได้ เนื่องจากในทางทฤษฎีแล้ว การเพิ่มอิเล็กโทรเนกาติวิตีควรเอื้อต่อการเกิดนามธรรมของโปรตอน
- ขนาดของประจุลบที่เกิดขึ้นระหว่างการแยกตัวออกจากกันส่งผลต่อค่าคงที่การแยกตัวในระดับที่มากกว่าอิเล็กโตรเนกาติวิตี
การแยกตัวของน้ำ
ตัวอย่างที่น่าสนใจของการแตกตัวคือการสลายตัวของโมเลกุลของน้ำ เนื่องจากมีความสามารถในการดึงโปรตอนและปล่อยโปรตอนออกไป น้ำบริสุทธิ์จึงผ่านการแยกตัวเองในระดับเล็กน้อย ตามสมการต่อไปนี้: H 2 O + H 2 O ↔ H 3 O + + OH – เช่นเดียวกับกรดและ ฐาน นอกจากนี้ยังเป็นไปได้ที่จะใช้กฎของการกระทำโดยมวลซึ่งรวมถึงความเข้มข้นที่สมดุลของน้ำที่ไม่แยกออกจากกันตลอดจนแอนไอออนและไอออนบวก: 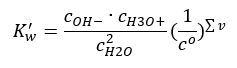 ปรากฎว่าความเข้มข้นของ H 3 O + ไอออนบวกและ OH – แอนไอออนนั้นน้อยมากเมื่อเทียบกับน้ำที่ไม่แยกออกจากกัน ซึ่งแม้แต่การเปลี่ยนแปลงในทางปฏิบัติก็ไม่เปลี่ยนความเข้มข้นของน้ำที่ไม่แยกตัว สิ่งนี้ทำให้สามารถสันนิษฐานได้ว่าค่านั้นเป็นค่าคงที่และแปลงสมการเป็นรูปแบบต่อไปนี้: K w = c OH – · c H3O + เป็นสิ่งสำคัญอย่างยิ่งในบริบทของการคำนวณทางเคมี และมีการอ้างถึงค่าคงที่ดังกล่าว เพื่อเป็นผลิตภัณฑ์ไอออนิกของน้ำ นอกจากนี้ยังมักใช้เป็นลอการิทึมเชิงลบ ซึ่งกำหนดให้เป็น pK w นี่เท่ากับ –logK w จากสมการ หากสมดุลไอออนของน้ำถูกรบกวนอันเป็นผลมาจากการจ่ายไอออน H 3 O + เพื่อรักษาความคงตัวของผลิตภัณฑ์ไอออนิก เราจะต้องลดความเข้มข้น ของ ไอออน OH ในทำนองเดียวกัน OH – ไอออนส่วนเกินจะลดความเข้มข้นของไอออนบวก ผลิตภัณฑ์ของความเข้มข้นเหล่านี้จะต้องคงที่ การทดลองแสดงให้เห็นว่า K w ที่อุณหภูมิ 298K คือ 10 -14 ดังนั้นเราจึงสามารถสังเกตสมการที่ใช้ได้สำหรับน้ำบริสุทธิ์ดังนี้:
ปรากฎว่าความเข้มข้นของ H 3 O + ไอออนบวกและ OH – แอนไอออนนั้นน้อยมากเมื่อเทียบกับน้ำที่ไม่แยกออกจากกัน ซึ่งแม้แต่การเปลี่ยนแปลงในทางปฏิบัติก็ไม่เปลี่ยนความเข้มข้นของน้ำที่ไม่แยกตัว สิ่งนี้ทำให้สามารถสันนิษฐานได้ว่าค่านั้นเป็นค่าคงที่และแปลงสมการเป็นรูปแบบต่อไปนี้: K w = c OH – · c H3O + เป็นสิ่งสำคัญอย่างยิ่งในบริบทของการคำนวณทางเคมี และมีการอ้างถึงค่าคงที่ดังกล่าว เพื่อเป็นผลิตภัณฑ์ไอออนิกของน้ำ นอกจากนี้ยังมักใช้เป็นลอการิทึมเชิงลบ ซึ่งกำหนดให้เป็น pK w นี่เท่ากับ –logK w จากสมการ หากสมดุลไอออนของน้ำถูกรบกวนอันเป็นผลมาจากการจ่ายไอออน H 3 O + เพื่อรักษาความคงตัวของผลิตภัณฑ์ไอออนิก เราจะต้องลดความเข้มข้น ของ ไอออน OH ในทำนองเดียวกัน OH – ไอออนส่วนเกินจะลดความเข้มข้นของไอออนบวก ผลิตภัณฑ์ของความเข้มข้นเหล่านี้จะต้องคงที่ การทดลองแสดงให้เห็นว่า K w ที่อุณหภูมิ 298K คือ 10 -14 ดังนั้นเราจึงสามารถสังเกตสมการที่ใช้ได้สำหรับน้ำบริสุทธิ์ดังนี้:  การแยกตัวยังเกี่ยวข้องกับค่า pH ของสารละลายอีกด้วย สารละลายที่มีความเข้มข้นเท่ากันของ H 3 O + ไอออนบวกและ OH – แอนไอออนจะแสดงค่า pH เป็นกลาง ในสารละลายที่เป็นกรด ความเข้มข้นของไอออนบวกจะสูงกว่า 10 -7 โมล/ลิตร ในขณะที่สารละลายที่เป็นด่างจะมีความเข้มข้นต่ำกว่า 10 -7 โมล/ลิตร
การแยกตัวยังเกี่ยวข้องกับค่า pH ของสารละลายอีกด้วย สารละลายที่มีความเข้มข้นเท่ากันของ H 3 O + ไอออนบวกและ OH – แอนไอออนจะแสดงค่า pH เป็นกลาง ในสารละลายที่เป็นกรด ความเข้มข้นของไอออนบวกจะสูงกว่า 10 -7 โมล/ลิตร ในขณะที่สารละลายที่เป็นด่างจะมีความเข้มข้นต่ำกว่า 10 -7 โมล/ลิตร

