Dissoziation ist im chemischen Kontext die Aufspaltung einer Substanz in andere Moleküle. Das Wort leitet sich vom lateinischen Begriff "dissociatio" ab, was "Trennung" bedeutet. In der wissenschaftlichen Nomenklatur gibt es verschiedene Definitionen für den Begriff der Dissoziation, wie er auch in der Psychologie vorkommt. Wir werden uns jedoch auf die Bedeutung der Dissoziation in der Chemie konzentrieren. Je nach Verfahren und verwendeter Substanz lassen sich verschiedene Arten der Dissoziation unterscheiden. Am häufigsten ist die elektrolytische Dissoziation, aber auch die thermische Dissoziation ist ein ebenso wichtiger Prozess.

Thermische Dissoziation
Bei diesem Prozess werden die Moleküle durch die Temperatur in kleinere Moleküle oder Atome zerlegt. Der wichtigste Zusammenhang ist, dass die verwendete Dissoziationstemperatur niedriger sein kann, wenn die Verbindung schwächere chemische Bindungen aufweist. Diejenigen, die eine höhere Energie zur Dissoziation benötigen, erfordern eine höhere Temperatur. Ein häufig anzutreffendes Beispiel für Thermolysereaktionen (thermische Dissoziation) ist die Karamellisierung von Saccharose, die bei 160oC stattfindet.
Elektrolytische Dissoziation
Im Vergleich zur thermischen Dissoziation, die 1887 vom schwedischen Chemiker Svante Arrhenius entdeckt wurde, ist dies ein etwas komplexerer Prozess. Bei der elektrolytischen Dissoziation wird eine Substanz unter dem Einfluss eines Lösungsmittels – in der Regel Wasser – in frei bewegliche Ionen zerlegt. Arrhenius zeigte in seinen Forschungen, dass die durch diese Art der Dissoziation gebildeten Ionen die Leitung des elektrischen Stroms durch eine gegebene Lösung bewirken. Dies führte auch zur Unterteilung von chemischen Substanzen in Elektrolyte, d.h. Lösungen, die Elektrizität leiten können, und Nichtelektrolyte – Lösungen, die keine Elektrizität leiten.
Elektrolyte
Der Begriff „Elektrolyte“ hat eine doppelte Bedeutung: aus technischer Sicht handelt es sich um alle Substanzen, die in der Lage sind, Ladungen ionisch zwischen Elektroden zu übertragen. Dadurch können sie Elektrizität ionisch leiten. Die zweite, eher chemische Bedeutung von Elektrolyten bezieht sich hingegen auf Substanzen, die durch Schmelzen oder Auflösen einer elektrolytischen Dissoziation unterliegen. Solche Lösungen, die in der Regel wässrig sind, sind auch elektrisch leitfähig. Beispiele für diese Art von Elektrolyten können sowohl ionische Verbindungen wie Natriumchlorid (Kochsalz) als auch nichtionische Verbindungen wie Salzsäure und Kaliumhydroxid sein. Aufgrund ihrer besonderen Eigenschaften können Elektrolyte als elektrische Leiter bezeichnet werden. Diese wiederum werden unterteilt in Leiter der ersten Ordnung – Metalle und ihre Legierungen sowie Kohlenstoff – und Leiter der zweiten Ordnung – Lösungen von Basen, Säuren und Salzen.
Mechanismus der elektrolytischen Dissoziation
In einem Lösungsmittel, dessen Dielektrizitätskonstante hoch ist (z.B. für Wasser gleich 81), sind die gegenseitigen Anziehungskräfte zwischen den Ionen des Kristallgitters stark geschwächt. Sie werden dann auseinandergerissen, was zur Auflösung der Substanz führt, wobei frei bewegliche Ionen in die Lösung freigesetzt werden. Solche Prozesse entstehen auch durch die Wechselwirkung zwischen Ionen und Wassermolekülen, die auf die polare Struktur von H2O zurückzuführen ist. Der Wirkungsmechanismus von Wasser bei der Zersetzung eines Elektrolyten mit ionischer Struktur beginnt nach Nekrassow damit, dass das positive Ion der Substanz den Gegenpol des Wassermoleküls anzieht und gleichzeitig den positiven Pol abstößt. Der entgegengesetzte Pol reagiert auf die gleiche Weise, und die von beiden Ionen angezogenen Wassermoleküle sammeln sich um sie herum. Diese Anziehungskraft ist gegenseitig zwischen den Dipolmolekülen und den Ionen, so dass die Anziehungskraft der Ionen im Elektrolyten erheblich geschwächt wird. Der Mechanismus kann daher in drei Hauptschritte unterteilt werden: den Übergang der polaren Struktur in eine ionische Struktur, die Bildung der ionischen Struktur und die Hydratisierung der Ionen. Die durch Dissoziation entstandenen Bindungen zwischen den Ionen und dem Lösungsmittel werden als Solvate bezeichnet. Wenn das Lösungsmittel Wasser ist – Hydrate.
Hydrathülle
Mit anderen Worten, es ist eine Hülle aus Wassermolekülen, die sich in unmittelbarer Nähe des Ions befinden und Polen mit entgegengesetztem Vorzeichen gegenüberstehen. Die freien, geladenen Pole ziehen aufeinanderfolgende Wasserschichten an, bis die Anziehung durch das Ion schwächer wird als die Energie der Molekularbewegung in der Lösung. Die Hülle erleichtert die Aufspaltung der Elektrolytmoleküle in Kationen und Anionen und bildet eine Barriere, die es den Ionen erschwert, sich wieder zu Molekülen zu verbinden.

Dissoziation von Säuren und Basen – Massenwirkungsgesetz
Als starke Säuren werden Säuren bezeichnet, die in wässriger Lösung eine weitgehende Dissoziation aufweisen, und als schwache Säuren solche, die nur geringfügig dissoziieren. Beim Vergleich der Stärke verschiedener Säuren sollten auch mehrere Faktoren berücksichtigt werden, wie die Neigung der Säuremoleküle, Protonen abzugeben, oder die Konzentration der betrachteten Substanz. Es gibt jedoch eine chemische Größe, die nicht von der Konzentration abhängt, sondern die individuellen Eigenschaften der Moleküle perfekt charakterisiert: die Dissoziationskonstante. Die Herleitung der Gleichung für diesen Wert muss mit der Aufstellung der Gleichung der Säuredissoziation beginnen. Für das monoprotonige Beispiel HX sieht das wie folgt aus:
![]()
Wenn die Lösung verdünnt und die Säure schwach ist, kann das Massenwirkungsgesetz angewendet werden, ausgedrückt durch die Gleichung:
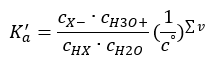
Es gibt zwei Möglichkeiten, die dargestellte Beziehung zu verkürzen. Der erste Schritt besteht darin, die Wasserkonzentration als Konstante anzunehmen. Das Symbol co kann auch weggelassen werden, da es eine Standardkonzentration von 1 mol/dm3 ausdrückt. Es ist jedoch wichtig, es in die Ausgangsformel einzubeziehen und bei der Bestimmung der Einheit zu berücksichtigen. Chemische Konstanten sind nämlich dimensionslose Werte. Dagegen haben alle in der Formel verwendeten Konzentrationen die Einheit mol/dm3. Letztendlich erhält man also die Formel für die Dissoziationskonstante:
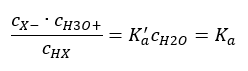
Die Beziehung, die die Dissoziationskonstante der Säure (Ka) ausdrückt, sind experimentell ermittelte Werte, die im Bereich von 10-10 bis 108 liegen. Es ist üblich, die Formel in logarithmischer Form zu verwenden, als den negativen Logarithmus der Dissoziationskonstante, bezeichnet als pKa:
pKa = -logKa
Eine wichtige Tatsache ist, dass, während niedrige Ka-Werte schwachen Säuren und große Werte starken Säuren entsprechen, so verhält es sich bei pKa genau umgekehrt. Kleine, meist negative pKa-Werte entsprechen starken Säuren. Positive, große pKa-Werte entsprechen dagegen schwachen Säuren. Durch die Einführung eines weiteren Begriffs – des Dissoziationsgrads (α), der das Verhältnis zwischen der Anzahl der Moleküle einer bestimmten chemischen Verbindung, die eine Dissoziation (Zerlegung in Ionen) durchlaufen, und der Gesamtzahl der Moleküle dieser Verbindung in der betrachteten Lösung angibt, kann die Gleichung weiterentwickelt werden. Vernachlässigt man die sehr geringe Konzentration von Wasserstoffionen, die aus der Dissoziation von Wasser resultiert, und verwendet die Gleichgewichtskonzentrationen von Ionen und Molekülen, kann man davon ausgehen, dass:
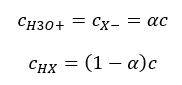
Dann kann die Dissoziationskonstante wie folgt geschrieben werden:

In dieser Form ist es die Abhängigkeit des Dissoziationsgrades eines Elektrolyten von seiner Konzentration, d.h. das Ostwaldsche Verdünnungsgesetz. Bei sehr schwachen Elektrolyten kann der Dissoziationsgrad α mit <<1 angenommen werden, und die Formel vereinfacht sich auf die Form:

Bei Säuren, die mehr als ein Proton in ihrer Struktur enthalten, findet eine mehrstufige Dissoziation statt, und es ist notwendig, alle Phasen zu berücksichtigen. Für Orthophosphorsäure gibt es zum Beispiel drei Stufen:
- H3PO4 + H2O = H2PO4– + H3O+
- H2PO4– + H2O = HPO42- + H3O+
- HPO42- + H2O = PO43- + H3O+
Jede Stufe hat ihre eigene Gleichgewichtskonstante, die in Analogie zur ersten Stufe aufgezeichnet werden kann:

Dissoziationskonstanten sind tabellierte Werte, sowohl für anaerobe, als auch für aerobe Säuren.
| Säure | Ka | pKa |
| HF | 6,3·10-4 | 3,2 |
| HCl | 1·107 | 7 |
| HNO3 | 27,54 | 1,44 |
| H3PO4 | 6,9·10-3 | 2,16 |
Tabelle 1. Beispiele für Werte von Dissoziationskonstanten für Säuren.
Der Prozess der Herstellung des Gleichgewichts der Basen während der Dissoziation ist analog. Anhand eines Beispiels für Base B kann die Gleichung in der Form geschrieben werden:
![]()
Will man nun die Dissoziationskonstante der Base ableiten, so erhält man unter Anwendung des Massenwirkungsgesetzes und unter der Annahme, dass die Wasserkonzentration in der verdünnten Lösung praktisch konstant ist, erhält man:

Je stärker die Base, desto höher die Dissoziationskonstante und desto niedriger der pKb-Wert, je schwächer die Base, desto niedriger die Dissoziationskonstante und desto höher der pKb-Wert.
| Base | Kb | pKb |
| Hydrazin | 3·10-6 | 5,5 |
| Ammoniak | 1,78·10-5 | 4,75 |
| Methylamin | 5,0·10-4 | 3,3 |
Tabelle 2. Beispiele für Werte von Dissoziationskonstanten für Basen.

Faktoren, die die Stärke von Säuren bestimmen
Wenn man die Ausdrücke der Dissoziationskonstanten bestimmter Säuren kennt, kann man einige wahre Annahmen machen:
- Die Kraft der anaeroben Säure steigt mit der Ordnungszahl des Elements, das an das Wasserstoffatom gebunden ist.
- Die Kraft der anaeroben Säure nimmt mit zunehmender Elektronegativität des an das Wasserstoffatom gebundenen Elements ab. Dies kann irreführend sein, da theoretisch eine Erhöhung der Elektronegativität die Aufspaltung von Protonen begünstigen sollte.
- Die Größe des bei der Dissoziation gebildeten Anions beeinflusst die Dissoziationskonstante stärker als die Elektronegativität.
Autodissoziation von Wasser
Ein interessanter Fall von Dissoziation ist der Zerfallsprozess von Wassermolekülen. Da sie sowohl die Fähigkeit besitzen, Protonen aufzunehmen als auch abzugeben, unterliegt reines Wasser einer geringen Autodissoziation gemäß folgender Gleichung:
H2O + H2O ↔ H3O+ + OH–
Analog zu Säuren und Basen kann man auch das Massenwirkungsgesetz anwenden, das die Gleichgewichtskonzentrationen von undissoziiertem Wasser und seinen Anionen und Kationen enthält:
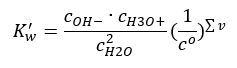
Es stellt sich heraus, dass die Konzentrationen der Kationen H3O+ und der Anionen OH– im Vergleich zum undissoziierten Wasser so gering sind, dass sich die Konzentration des undissoziierten Wassers selbst bei einer Änderung der Kationen kaum ändert. Es ist also möglich, diesen Wert als Konstante zu nehmen und die Formel umzuwandeln, so dass sie auf die folgende Form verkürzt wird:
Kw = cOH– · cH3O+
Dies ist ein besonders wichtiger Aspekt im Rahmen chemischer Berechnungen, und eine solche Konstante wird als Ionenprodukt des Wassers bezeichnet. Er wird häufig auch als negativer Logarithmus verwendet, der als pKw bezeichnet wird. Dies ist gleich der Notation -logKw. Wenn das Ionengleichgewicht des Wassers durch die Zufuhr von Ionen des Typs H3O+ gestört wird, ist eine Verringerung der Konzentration der Ionen des Typs OH– erforderlich, um das Ionenprodukt konstant zu halten, wie aus der Gleichung hervorgeht. In ähnlicher Weise führt ein Überschuss an Ionen OH– zu einer Verringerung der Kationenkonzentration. Das Produkt aus diesen Konzentrationen muss konstant bleiben. Experimentell wurde berechnet, dass der Kw-Wert bei 298 K 10-14 beträgt. Die korrekte Gleichung für reines Wasser kann daher auch wie folgt geschrieben werden:

Der pH-Wert einer Lösung ist auch mit der Dissoziation verbunden. Lösungen mit gleichen Konzentrationen von Kationen H3O+ und Anionen OH– reagieren neutral. In sauren Lösungen ist die Kationenkonzentration höher als 10-7 mol/l und in alkalischen Lösungen ist sie niedriger als 10-7 mol/l.
