Dysocjacją, w kontekście chemicznym, nazywamy rozpad substancji na inne molekuły. Słowo to pochodzi od łacińskiego zwrotu „dissociatio”, który oznacza „rozdzielenie”. W naukowej nomenklaturze dysocjacja przybiera różne definicje, ponieważ spotykana jest także w takiej dziedzinie jak psychologia. My jednak skupimy się na znaczeniu dysocjacji w chemii. W zależności od przebiegu procesu oraz wykorzystywanej w nim substancji wyróżnić możemy różne rodzaje dysocjacji. Najbardziej popularną jest dysocjacja elektrolityczna, jednak równie ważnym procesem jest też dysocjacja termiczna.

Dysocjacja termiczna
Proces ten polega na rozpadzie cząsteczek na mniejsze cząsteczki bądź na atomy, w wyniku działania temperatury. Najważniejszą zależnością jest tu fakt, iż użyta temperatura dysocjacji może być niższa, jeżeli w związku występują słabsze wiązania chemiczne. Te o wyższej energii potrzebnej do rozpadu, wymagają wyższej temperatury. Przykładem, z którym spotykamy się powszechnie dla reakcji termolizy (dysocjacji termicznej) jest karmelizacja sacharozy, zachodząca w temperaturze 160oC.
Dysocjacja elektrolityczna
Jest nieco bardziej złożonym procesem w porównaniu do dysocjacji termicznej, odkrytym przez szwedzkiego chemika Svante Arrheniusa w 1887 r.. Dysocjacja elektrolityczna polega na rozpadzie substancji, zachodzącej pod wpływem rozpuszczalnika – najczęściej wody, na swobodnie poruszające się jony. Arrhenius w swoich badaniach wykazał, że jony powstające w wyniku tego typu dysocjacji powodują przewodzenie prądu elektrycznego przez dany roztwór. W ten sposób powstał również podział substancji chemicznych na elektrolity, czyli roztwory zdolne do przewodzenia prądu elektrycznego oraz nieelektrolity – roztwory nie przewodzące prądu elektrycznego.
Elektrolity
Określenie „elektrolity” posiada dwojakie znaczenie – z technicznego punktu widzenia, jest to każda substancja, będąca w stanie przekazywać jonowo ładunek pomiędzy elektrodami. W wyniku powyższego, może przewodzić jonowo prąd elektryczny. Drugie, bardziej chemiczne znaczenie elektrolitów odnosi się natomiast do substancji, które ulegają dysocjacji elektrolitycznej w wyniku stopienia lub rozpuszczania. Takie roztwory, najczęściej wodne, również przewodzą prąd elektryczny. Przykładami tego typu elektrolitów mogą być związki zarówno jonowe, takie jak chlorek sodu (sól kuchenna), ale również niejonowe, na przykład kwas chlorowodorowy oraz wodorotlenek potasu. Przez wzgląd na swoje szczególne właściwości, elektrolity możemy nazwać przewodnikami elektrycznymi. Te z kolei, dzielą się na przewodniki pierwszego rodzaju – metale i ich stopy oraz węgiel, a także drugiego rodzaju – roztwory zasad, kwasów i soli.
Mechanizm dysocjacji elektrolitycznej
W rozpuszczalniku, którego stała dielektryczna jest duża (np. dla wody równa 81), siły wzajemnego przyciągania jonów sieci krystalicznej są mocno osłabione. Następuje wtedy ich rozrywanie, skutkujące rozpuszczaniem się substancji z wydzieleniem swobodnie poruszających się jonów do roztworu. Takie procesy następują również ze względu na wzajemne oddziaływanie pomiędzy jonami a cząsteczkami wody, co wynika z polarnej budowy H2O. Mechanizm działania wody, podczas rozpadu elektrolitu o budowie jonowej według Niekrasowa, rozpoczyna jon dodatni substancji, który przyciąga przeciwny biegun cząsteczki wody, równocześnie odpychając biegun dodatni. W ten sam sposób oddziałuje przeciwny biegun, a wokół obu jonów zbierają się przyciągnięte przez nie cząsteczki wody. Takie przyciąganie jest obustronne pomiędzy dipolowymi cząsteczkami oraz jonami, przez co siła przyciągania jonów w elektrolicie ulega znacznemu osłabieniu. Mechanizm można więc podzielić na trzy główne etapy – przejście struktury polarnej w jonową, utworzenie struktury jonowej i hydratacja jonów. Powstałe w wyniku dysocjacji połączenia pomiędzy jonami oraz rozpuszczalnikiem nazywa się solwatami. Jeżeli rozpuszczalnikiem jest woda – hydratami.
Otoczka hydratacyjna
Jest to inaczej otoczka złożona z cząsteczek wody, obecnych w najbliższym sąsiedztwie jonu i zwróconych biegunami przeciwnego znaku. Wolne, naładowane bieguny przyciągają kolejne warstwy wody, aż do momentu, w którym przyciąganie przez jon staje się słabsze niż energia ruchu molekularnego w roztworze. Otoczka ułatwia rozpad cząsteczek elektrolitu na kationy i aniony oraz stanowi barierę, która utrudnia ponowne łączenie jonów na cząsteczki.

Dysocjacja kwasów i zasad – prawo działania mas
Mocnym kwasem nazywamy kwasy, które w roztworze wodnym wykazują daleko posuniętą dysocjację, a kwasem słabym takie, które dysocjują jedynie w niewielkim stopniu. Porównując moc różnych kwasów należy również wziąć pod uwagę kilka czynników, takich jak tendencja cząsteczek kwasu do oddawania protonów, czy też stężenie rozważanej substancji. Istnieje jednak wielkość chemiczna, która nie jest zależna od stężenia, ale doskonale charakteryzuje indywidualne właściwości cząsteczek – stała dysocjacji. Wyprowadzenie równania dla tej wartości należy zacząć od rozpisania równania dysocjacji kwasu. Dla jednoprotonowego przykładu HX będzie ono wyglądało następująco:
![]()
Jeżeli roztwór jest rozcieńczony, a kwas słaby, możliwe jest do zastosowania prawo działania mas, wyrażone równaniem:
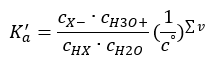
Możliwe są dwie drogi skrócenia przedstawionej zależności. Pierwszym krokiem jest przyjęcie stężenia wody jako stałego. Można również pominąć symbol co, gdyż wyraża on stężenie standardowe o wartości równej 1 mol/dm3. Ważne jest jednak umieszczenie go w początkowym wzorze i wzięcie pod uwagę przy wyznaczaniu jednostki. Stałe chemiczne są bowiem wartościami bezwymiarowymi. Natomiast wszystkie używane we wzorze stężenia posiadają jednostkę mol/dm3. Ostatecznie otrzymujemy więc wzór na stałą dysocjacji:
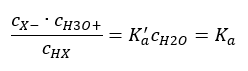
Zależność, wyrażająca stałą dysocjacji kwasu (Ka), stanowią wartości wyznaczone eksperymentalnie, zawierające się w przedziale rzędów od 10-10 do 108. Częstym zabiegiem jest używanie wzoru w postaci logarytmicznej, jako ujemny logarytm stałej dysocjacji oznaczany jako pKa:
pKa = -logKa
Ważnym faktem jest, że o ile niskie wartości Ka odpowiadają słabym kwasom, a duże wartości mocnym kwasom, o tyle w przypadku pKa zmienia w przeciwny sposób. Małe, zazwyczaj ujemne wartości pKa, odpowiadają mocnym kwasom. Natomiast dodatnie, duże wartości pKa – słabym kwasom. Wprowadzając kolejne pojęcie – stopień dysocjacji (α), który oznacza stosunek liczby moli cząstek danego związku chemicznego, ulegających dysocjacji (rozpadowi na jony), do całkowitej liczby moli cząsteczek tego związku, obecnych w rozważanym roztworze, można dalej rozwijać równanie. Zaniedbując bardzo niskie stężenie jonów wodorowych powstałych w wyniku dysocjacji wody i wykorzystując stężenia równowagowe jonów oraz cząsteczek, można założyć, że:
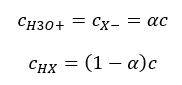
Wtedy, stałą dysocjacji można zapisać jako:

W takiej formie, jest to zależność stopnia dysocjacji elektrolitu od jego stężenia, czyli prawo rozcieńczeń Ostwalda. W przypadku rozważania bardzo słabych elektrolitów, stopień dysocjacji α można założyć jako <<1, a wzór uprościć do postaci:

W przypadku kwasów, które zawierają w swojej strukturze więcej niż jeden proton, występuje dysocjacja wielostopniowa i konieczne jest uwzględnienie wszystkich jej etapów. Na przykład, dla kwasu ortofosforowego są to trzy etapy:
- H3PO4 + H2O = H2PO4– + H3O+
- H2PO4– + H2O = HPO42- + H3O+
- HPO42- + H2O = PO43- + H3O+
Każdy z etapów posiada swoją stałą równowagi, które można rozpisać analogicznie do pierwszego z nich:

Stałe dysocjacji są wartościami stabelaryzowanymi, zarówno dla kwasów beztlenowych, jak i tlenowych.
| Kwas | Ka | pKa |
| HF | 6,3·10-4 | 3,2 |
| HCl | 1·107 | -7 |
| HNO3 | 27,54 | -1,44 |
| H3PO4 | 6,9·10-3 | 2,16 |
Tabela 1. Przykładowe wartości stałej dysocjacji dla kwasów.
Analogicznie przebiega proces ustalania się równowagi zasad podczas dysocjacji. Biorąc pod uwagę przykładową zasadę B, równanie można zapisać w postaci:
![]()
Następnie, chcąc wyprowadzić stałą dysocjacji zasady, z wykorzystaniem prawa działania mas oraz z założeniem, że stężenie wody w rozcieńczonym roztworze jest praktycznie stałe, otrzymujemy:

Im mocniejsza jest zasada, tym większa stała dysocjacji i tym mniejsza wartość pKb, natomiast tym słabsza zasada im niższa stała dysocjacji i im większa wartość pKb.
| Zasada | Kb | pKb |
| Hydrazyna | 3·10-6 | 5,5 |
| Amoniak | 1,78·10-5 | 4,75 |
| Metyloamina | 5,0·10-4 | 3,3 |
Tabela 2. Przykładowe wartości stałych dysocjacji dla zasad.

Czynniki decydujące o mocy kwasów
Znając wyrażenia stałych dysocjacji konkretnych kwasów, można wysnuć kilka prawdziwych założeń:
- Moc kwasu beztlenowego wzrasta wraz ze wzrostem liczby atomowej pierwiastka połączonego z atomem wodoru.
- Moc kwasu beztlenowego maleje, wraz ze wzrostem elektroujemności pierwiastka przyłączonego do atomu wodoru. Może być to mylące, ze względu na to, iż w teorii zwiększenie elektroujemności powinno sprzyjać odszczepianiu protonów.
- Rozmiar anionu powstającego w trakcie dysocjacji wpływa w większym stopniu na stałą dysocjacji niż elektroujemność.
Autodysocjacja wody
Ciekawym przypadkiem dysocjacji jest proces rozpadu cząsteczek wody. Ze względu na to, że posiadają one zarówno zdolność do pobierania protonów, jak i ich oddawania, czysta woda ulega w małym stopniu autodysocjacji, według równania:
H2O + H2O ↔ H3O+ + OH–
Możliwym jest również, analogiczne do kwasów i zasad, zastosowanie prawa działania mas, zawierającego stężenia równowagowe wody niezdysocjowanej oraz jej anionów i kationów:
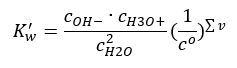
Okazuje się, że stężenia kationów H3O+ i anionów OH– są tak niewielkie w porównaniu do niezdysocjowanej wody, że nawet ich zmiana praktycznie nie zmienia stężenia wody niezdysocjowanej. Dzięki temu, możliwe jest przyjęcie tej wartości jako stałej i przekształcenie wzoru, skracając go do formy:
Kw = cOH– · cH3O+
Jest to szczególnie ważny aspekt w kontekście obliczeń chemicznych, a taką stałą nazywa się iloczynem jonowym wody. Często stosuje się go również jako ujemny logarytm, oznaczany jako pKw. Jest to równe zapisowi –logKw. Wnioskując z równania, jeżeli równowaga jonowa wody zostanie zakłócona w wyniku dostarczenia jonów H3O+, dla zachowania stałości iloczynu jonowego konieczne jest obniżenie stężenia jonów OH–. Analogicznie też nadmiar jonów OH– skutkuje obniżeniem stężenia kationów. Iloczyn tych stężeń musi pozostać stały. Doświadczalnie wyliczono, że Kw w temperaturze 298K wynosi 10-14. Poprawne dla czystej wody równanie można więc również zapisać jako:

Z dysocjacją jest również powiązane pH roztworu. Roztwory o równych stężeniach kationów H3O+ oraz anionów OH– posiadają odczyn obojętny. W roztworach kwaśnych, stężenie kationów jest wyższe niż 10-7 mol/l, a w alkalicznych mniejsze niż 10-7 mol/l.
