Міцели – це мікроскопічні скупчення молекул, що характеризуються сферичною структурою. Вони є поширеною та дуже ефективною групою поверхнево-активних сполук, тобто поверхнево-активних речовин. Завдяки своїм унікальним властивостям вони відіграють дуже важливу роль у багатьох галузях промисловості, зокрема в косметології.

Завдяки своїй структурі міцели практично поглинають усілякі забруднення з поверхні, на яку їх наносять. Міцели найчастіше згадуються в контексті косметики для очищення обличчя, але вони також є інгредієнтами в таких продуктах, як пральні порошки та засоби для миття посуду. Міцелярні розчини характеризуються здатністю розчиняти важкорозчинні сполуки, що є визначенням процесу солюбілізації.
Будова та властивості міцел
Структура міцел визначає їхні унікальні фізико-хімічні властивості. У цьому розділі ми розглянемо, як утворюються міцели, з чого вони складаються та які процеси визначають їхню поведінку в розчинах.
Очима хіміка
Міцели – це не що інше, як асоціативні колоїди, що утворюються в результаті процесу міцелізації . Цей процес стосується перетворення амфіфільних молекул або іонів, які в результаті розчинення зазнають самоасоціації у більші кластери.
Таким чином, міцели – це не специфічна група хімічних сполук, а радше специфічна форма організації їхніх молекул. Це спонтанне перетворення, що призводить до утворення міцел, характерне для різних органічних речовин, молекули яких складаються з двох частин зі суттєво різною полярністю.
Коли вміст поверхнево-активних речовин у розчині збільшується, при певній концентрації асоціатів починають формуватися ці характерні структури. Початковою точкою для таких перетворень називається концентрація КМЦ.
Що означає абревіатура CMC?
КМК, або критична концентрація міцелізації , – це концентрація, за якої міцели починають формуватися в результаті саморозпаду накопичених мономерів у більші агрегати . Це утворення кластерів молекул також супроводжується зміною їхніх фізичних властивостей.
Вище КМК така група молекул залишається в рівновазі з окремими молекулами, таким чином перетворюючись на термодинамічно стабільну форму. Ця рівновага є ключовою точкою переходу, оскільки вона може безперервно відбуватися в обох напрямках. Наприклад, під час розведення міцели знову руйнуються. Нижче концентрації КМК молекули поверхнево-активної речовини вільно рухаються в розчині без будь-якої організованої структури.
Фізичні властивості міцел
Зі збільшенням концентрації поверхнево-активної речовини в розчині відбуваються такі зміни:
- Поверхневий натяг,
- Електропровідність,
- Інтенсивність розсіювання світла,
- В’язкість.
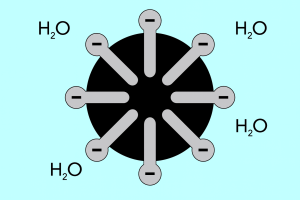
Голова та хвіст – будова міцел
Структуру міцел можна розділити на дві основні частини, які суттєво відрізняються полярністю та називаються:
- Гідрофільна головка , яка має високу спорідненість до води. Це частина міцели, яка відповідає за схильність частинок до з’єднання з водою, а також за відштовхування жирів.
- Гідрофобний хвіст , також відомий як ліпофільний хвіст, має протилежний ефект – він притягує молекули до жирів і відштовхує воду.
Гідрофобна ділянка найчастіше являє собою вуглеводневі ланцюги, радикали:
- алкіл,
- алкіларил,
- фторовані вуглеводневі радикали.
Гідрофільна область складається з груп, які достатньо сильно взаємодіють з водою, таких як іоногенні групи. Неіонні групи, такі як ефірні групи, також можуть утворювати частину гідрофільної області міцел, але це зазвичай вимагає наявності більшої кількості полярних груп у молекулі.
Процес міцелізації
Через те, що неполярна частина речовини, наприклад, алкільний ланцюг однієї диспергованої молекули поверхнево-активної речовини, має велику площу поверхні контакту з водою, а взаємодія між кількома молекулами води набагато сильніша, ніж їхня взаємодія з групами –CH2 , присутніми в ланцюзі, ентропія системи зменшується, і молекули води починають організовуватися в місці алкільного ланцюга.
Це викликає своєрідне витіснення вуглеводневих ланцюгів з внутрішньої частини водної фази. Зі збільшенням концентрації поверхнево-активної речовини збільшується і кількість зіткнень між ними. Це також збільшує ймовірність агрегації та згущення молекул.
Конденсація молекул супроводжується зменшенням вільної ентальпії. Це також є результатом поєднання неполярних залишків з неполярним ядром у рідкому стані, яке відокремлене від водної фази полярними групами.
Після досягнення вищезгаданої концентрації КМЦ, тобто критичної концентрації міцел, накопичуються сферичні кластери, в яких полярні групи окремих частинок спрямовані до водної фази, тоді як неполярні вуглеводневі ланцюги утворюють внутрішню частину. Міцели, утворені таким чином, називаються нормальними міцелами.
В органічних розчинниках можуть виникати зворотні міцели, в яких гідрофобна частина розташована зовні.

Типи та приклади поверхнево-активних речовин
Тип поверхнево-активних речовин, що використовуються для утворення міцел, має величезний вплив на їхню структуру та функціональність. Нижче ви знайдете найпоширеніші типи та приклади поверхнево-активних речовин, що утворюють міцели
Приклади поверхнево-активних іонів
Негативно заряджені іони, катіони:
- карбоксилат,
- сульфат,
- сульфонат,
- фосфат.
Позитивно заряджені іони, катіони:
- амоній,
- фосфоній.
Типи поверхнево-активних речовин
- Іонні поверхнево-активні речовини
- Аніонні, наприклад, SDS, або додецилсульфат натрію,
- Катіонні, наприклад, CTAB, або цетилтриметиламонію бромід,
- Амфіони, тобто іони, які називаються амфіфільними або біполярними, що мають як позитивно заряджену катіонну групу, так і негативно заряджену аніонну групу, наприклад, лецитин, тобто фосфатидилолін.
- Неіоногенні поверхнево-активні речовини, наприклад, поліоксіетилени.
Поверхнева активність поверхнево-активних речовин та структура міцел
Цей параметр, характерний для поверхнево-активних сполук, збільшується зі збільшенням кількості метиленових груп, присутніх у вуглеводневому ланцюзі.
Завдяки структурі ланцюга міцели можна розділити на:
- Одноланцюговий
- Аніонний, наприклад, SDS,
- Катіонні, наприклад, CTAB.
- Подвійний ланцюг
- Аніонний, наприклад, AOT, тобто біс(2-етилгексил)сукцинатсульфонат натрію,
- Катіонні, наприклад, дигексадецилдиметиламонію бромід.
- Молекулярний, наприклад, МГДГ, тобто моногалактозилдигліцерид.

Застосування міцел
Міцели мають широкий спектр застосування, від косметології до фармацевтики та хімічної промисловості. Дізнайтеся про найважливіші сфери, де їхні властивості використовуються на практиці.
Ефективне очищення шкіри
Це можливо завдяки наявності як ліпофільних, так і гідрофільних частинок. Наприклад, у засобах для зняття макіяжу, що містять міцелярну воду, гідрофобні частинки зв’язуються з шкірним салом та залишками макіяжу на шкірі, тоді як гідрофільні частинки притягують пил та бруд. Це призводить до подвійного очищувального ефекту, що забезпечує ефективне та ретельне очищення без зайвого пересушування чи подразнення.
Міцелярні продукти рекомендуються навіть для чутливої шкіри завдяки їхній м’якій дії. Немає потреби сильно терти чи натискати ватними дисками, а дію цих колоїдів порівнюють з дією магніту на бруд. Водні розчини з міцелами не порушують гідроліпідний шар епідермісу.
Створення міцелярної косметики
Ще однією перевагою міцел, які являють собою дуже дрібні частинки, є відсутність обмежень щодо рецептур, у яких їх можна використовувати. Їх можна використовувати в найпопулярнішій формі – міцелярній воді – а також у кремах та лосьйонах.
Також доступні висококонцентровані гелеві формули, які не потребують використання рушників чи ватних дисків, а лише втирають у шкіру та змивають водою.
Тристадійна дія міцел
- Притягування домішок завдяки гідрофобним хвостам,
- Інкапсуляція , яка захоплює молекули жиру та бруду всередині міцел,
- Видалення домішок, що потрапили в міцели, через гідрофільні головки, що залишаються в контакті з водною фазою.
Інші промислові застосування міцел
- Косметологія , переважно міцелярні рідини та лосьйони для зняття макіяжу, а також міцелярні шампуні для глибокого очищення шкіри голови та гелі для душу.
- Фармацевтика , наприклад, для підвищення біодоступності активних речовин шляхом введення в організм препаратів з обмеженою розчинністю у вигляді неіоногенних міцелярних розчинів.
- Засоби для чищення – вищезгаданий процес солюбілізації пояснює фізико-хімічні процеси прання. Міцелярні колоїди у вигляді розчинів оточують жир, відокремлюють бруд і видаляють його з тканини. При використанні іонних поверхнево-активних речовин частинки бруду та поверхня, до якої вони прилипають, набувають однакового заряду, що дозволяє легко відокремлювати їх одна від одної.
- Фізичні та хімічні процеси : міцелярний каталіз, гальмування хімічних реакцій, процеси флотації та вилучення нафти.
- Witek K. Synteza, właściwości powierzchniowe i zastosowanie surfaktantów amfoterycznych, zawierających ugrupowania labilne, Politechnika Wrocławska 2022
- K.Michocka Otrzymywanie i właściwości użytkowe nowych surfaktantów z ugrupowaniem cukrowym, Uniwersytet Ekonomiczny w Poznaniu 2012
- A.Piotrowska-Kirschling, J.Drzeżdżon, L.Chmurzyński, D.Jacewicz Krytyczne stężenie micelarne i metody jego wyznaczania, Wiadomości chemiczne 2018
- https://wydawnictwo.ue.poznan.pl/books/978-83-8211-090-6/sample.pdf
- https://home.agh.edu.pl/~nmos1/FUK/fizykochemia_powierzchni_skany/15/dutkiewicz_15.pdf
- https://phavi.umcs.pl/at/attachments/2018/0608/143246-chemia-koloidow-cwiczenie-1.pdf






























































































































