Это группа неорганических соединений, образованных путем соединения различных элементов с кислородом, с общей формулой XnOm, где „X” обозначает любой элемент, „O” обозначает кислород, всегда во второй степени окисления, а буквы „n,m” в нижнем индексе – это коэффициенты. Примерами оксидов являются вода H2O, оксид калия K2O, оксид алюминия Al2O3, оксид кальция CaO и оксид углерода(II) CO.

Виды оксидов
Оксиды делятся на несколько категорий. Наиболее общим является деление на оксиды металлов, например, лития, магния, алюминия, железа и оксиды неметаллов, включая оксиды углерода, азота, серы и хлора. Другим критерием является деление по агрегатному состоянию. Твердыми телами являются почти все оксиды металлов и некоторые неметаллы (SiO2, P4O10), жидкостями являются вода, оксид серы(VI) и оксид марганца(VII), а газообразными оксидами являются, прежде всего, оксиды неметаллов, такие как CO, CO2, SO2, NO и NO2. Оксиды также можно разделить по типу связи, возникающей в них. Оксид магния MgO, оксид кальция CaO или оксид натрия Na2O содержат ионы O2- и ионные связи, отсюда и их название – ионные оксиды. Другую группу составляют ковалентные оксиды, например окись углерода(II) CO, окись азота(II) NO или окись серы(IV) SO2, в которых связь между атомом кислорода и элементом принимает форму ковалентной полярной связи.
Химический характер оксидов
Наиболее интересное для химиков деление относится к химической природе оксидов. Различают четыре основные категории оксидов: кислотные, основные, нейтральные и амфотерные.
- Кислотные оксиды, иногда также называемые кислотными ангидридами, отличающиеся тем, что, реагируя с основаниями, они образуют соль. Значительная часть кислотных оксидов при растворении в воде образует соответствующие растворы кислотных оксидов. Это происходит, в том числе, с оксидом серы(IV), который при растворении в воде образует серную(IV) кислоту, и с оксидом хрома(VI), растворяющимся в хромовую кислоту(VI):
SO2 + H2O → H2SO3
CrO3 + H2O → H2CrO4
Существует небольшая группа кислотных оксидов, нерастворимых в воде. Однако они растворимы в растворах сильных оснований, к которым относятся оксид кремния(IV) SiO2, оксид молибдена(VI) MoO3 и оксид вольфрама(VI) WO3. Их реакции с основаниями подтверждают кислотный характер:
SiO2 + 2NaOH → Na2SiO3 + H2O
MoO3 + 2KOH → K2MoO4 + H2O
WO3 + 2NaOH → Na2WO4 + H2O
Как правило, кислотные оксиды представляют собой оксиды неметаллов и оксиды металлов в их максимально возможных степенях окисления. В тех случаях, когда данный элемент образует несколько оксидов в разных степенях окисления, например хром, с повышением степени окисления увеличиваются и кислотные свойства образованных им оксидов:
- оксид хрома (II) CrO имеет основной характер,
- оксид хрома (III) Cr2O3 обладает амфотерными свойствами,
- оксид хрома (VI) CrO3 имеет кислотную природу.

- Основные оксиды – это такие соединения кислорода и металлов, которые, реагируя с кислотами, образуют соль. Для некоторых из них, т.е. оксидов, образующихся с элементами первой и второй групп периодической системы химических элементов, за исключением бериллия, также характерна реакция с водой, приводящая к образованию основных гидроксидов. Это происходит, например, при взаимодействии оксидов натрия, лития и бария с водой:
Na2O + H2O → 2NaOH
Li2O + H2O → 2LiOH
BaO + H2O → Ba(OH)2
Существуют также основные оксиды, которые не растворяются в воде, а только в растворах кислот. К ним относятся, среди прочего, оксид марганца(II) и оксид железа(II):
MnO + H2SO4 → MnSO4 + H2O
FeO + 2HCl → FeCl2 + H2O
- Нейтральные оксиды – наименее реакционноспособная группа оксидов. Они не реагируют ни с кислотами, ни с основаниями. Они также нерастворимы в воде. Представителями этой группы оксидов являются окись углерода(II) CO и окись азота(II) NO.
- Амфотерные оксиды являются полной противоположностью нейтральным оксидам и одновременно являются и кислотными, и основными. Это означает, что они реагируют как с сильными основаниями, так и с кислотами. Продуктами таких реакций всегда являются соли, а тот элемент, который первоначально соединяется с кислородом, превращается в соответствующий катион или анион кислотного остатка. Единственным сходством с нейтральными оксидами является их плохая растворимость в воде. Примерами амфотерных оксидов являются оксид бериллия BeO, оксид алюминия Al2O3, вышеупомянутый оксид хрома(III), оксид олова(II) SnO, оксид свинца(II) PbO и оксид цинка ZnO. Реагируя с водными растворами сильных оснований, например с водным раствором гидроксида натрия, они образуют комплексные соли. В их кислотных остатках находятся атомы или ионы металла, происходящего из оксида, в комплексе с соответствующим количеством гидроксильных групп. Их количество зависит от координационного числа, характеризующего данный элемент. Например, атомы, полученные из оксидов типа MO (M – металл), т.е. таких как оксид бериллия BeO, имеют координационное число 4. Атомы производных оксидов типа M2O3, например Al2O3, могут иметь два различных координационных числа, в зависимости от условий реакции — 4 или 6. Пример реакции амфотерных оксидов:
BeO + 2HCl → BeCl2 + H2O
BeO + 2NaOH + H2O → Na2[Be(OH)4] тетрагидроксостаннат натрия
Al2O3 + 6HCl → 2AlCl3 + 3H2O
Al2O3 + 2KOH + 3H2O → 2K[Al(OH)4] тетрагидроксоалюминат калия
Al2O3 + 6NaOH + 3H2O → 2Na3[Al(OH)6] гексагидроксоалюминат натрия
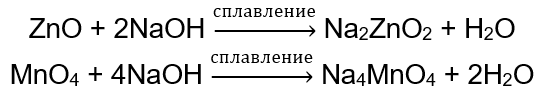
Некоторые оксиды, такие как оксид цинка и оксид марганца(IV), проявляют весьма специфические амфотерные свойства. Последний ни в нормальных, ни в стандартных условиях не реагирует ни с какими основаниями. Оба же, напротив, реагируют с ними, сплавляясь с твердыми основаниями, например:

Получение оксидов
- Прямой синтез элементов:
a) синтез атомов серы и кислорода с получением оксида серы(IV)
S + O → SO2
b) синтез атомов магния и кислорода с получением оксида магния
2Mg + O2 → 2MgO
c) синтез атомов углерода и кислорода с получением оксида углерода(IV)
C + O2 → CO2 - Термическое разложение солей, гидроксидов и оксидов:
a) разложение карбоната кальция на оксид кальция и оксид углерода(IV)
CaCO3 → CaO + CO2
b) разложение гидроксида меди(II) на оксид меди(II) и воду
Cu(OH)2 → CuO + H2O
c) разложение оксида марганца(IV) на оксид марганца(III) и кислород
4MnO2 → 2Mn2O3 + O2 - Окисление оксидов при более низких степенях окисления с повышением их валентности:
a) окисление оксида серы(IV) до оксида серы(VI)
2SO2 + O2 → 2SO3
b) окисление оксида азота(II) до оксида азота(IV)
2NO + O2 → 2NO2
c) окисление оксида углерода(II) до оксида углерода(IV)
2CO + O2 → 2CO2
- Восстановление оксидов при более высоких степенях окисления с понижением их валентности:
a) восстановление оксида углерода(IV) до оксида углерода(II)
CO2 + C → 2CO
b) восстановление оксида олова(II) до оксида олова(I)
2SnO + O2 → 2SnO2 - Горение органических соединений:
a) горение метана в кислороде с образованием оксида углерода(IV) и воды
CH4 + 2O2 → CO2 + 2H2O
b) горение аммиака в кислороде с получением оксида азота(II) и воды
4NH3 + 5O2 → 4NO + 6H2O - Реакция неустойчивых оксикислот:
a) разложение угольной кислоты(IV) до оксида углерода(IV) и воды:
H2CO3 → CO2 + H2O
b) разложение серной кислоты(IV) до оксида серы(IV) и воды:
H2SO3 → SO2 + H2O
