Este es un grupo de compuestos inorgánicos formados por la combinación de varios elementos con oxígeno. Su fórmula general es X n O m , donde "X" es cualquier elemento, "O" es oxígeno, siempre en el segundo estado de oxidación, y las letras "n,m" en el índice inferior son coeficientes. Ejemplos de óxidos: agua H 2 O, óxido de potasio K 2 O, óxido de aluminio Al 2 O 3 , óxido de calcio CaO y monóxido de carbono (II) CO.

Clasificación de los óxidos
Los óxidos se pueden clasificar en varias categorías. La clasificación más general es la distinción entre óxidos metálicos, por ejemplo, óxido de litio, óxido de magnesio, óxido de aluminio, óxido de hierro y óxidos no metálicos, incluidos óxido de carbono, óxido de nitrógeno, óxido de azufre y óxido de cloro . Otro criterio es la clasificación según su estado físico. Casi todos los óxidos metálicos y algunos no metales (SiO 2 , P 4 O 10 ) son sólidos. El agua, el óxido de azufre (VI) y el óxido de manganeso (VII) son líquidos. Los óxidos no metálicos como CO, CO 2 , SO 2 , NO i NO 2 son gases. Los óxidos también se pueden clasificar según el tipo de enlaces que se producen en ellos. El óxido de magnesio MgO, el óxido de calcio CaO o el óxido de sodio Na 2 O contienen iones O 2- y enlaces iónicos, de ahí su nombre: óxidos iónicos. Otro grupo son los óxidos covalentes, por ejemplo, el monóxido de carbono (II) CO, el óxido nítrico (II) NO o el óxido de azufre (IV) SO2 , en los que el enlace entre el átomo de oxígeno y el elemento tiene la forma de un enlace covalente polar.
El carácter químico de los óxidos.
Para los químicos, la clasificación más interesante se basa en la naturaleza química de los óxidos. Hay cuatro categorías principales de óxidos: ácidos, básicos, neutros y anfóteros.
- Los óxidos ácidos , a veces también llamados anhídridos ácidos, se distinguen por el hecho de que reaccionan con los álcalis formando sal. Una parte significativa de los óxidos ácidos forman soluciones apropiadas de oxiácidos después de la disolución en agua. Esto se aplica, por ejemplo, al óxido de azufre (IV), que cuando se disuelve en agua produce ácido sulfúrico (IV) , y al óxido de cromo (VI), que se disuelve en ácido crómico (VI):
SO 2 + H 2 O → H 2 SO 3 CrO 3 + H 2 O → H 2 CrO 4 Hay un pequeño grupo de óxidos ácidos que son insolubles en agua. Sin embargo, son solubles en soluciones de álcalis fuertes , por ejemplo, silicio ( IV) óxido SiO 2 , óxido de molibdeno (VI) MoO 3 y óxido de tungsteno (VI) WO 3 . Sus reacciones con los álcalis confirman su carácter ácido: SiO 2 + 2NaOH → Na 2 SiO 3 + H 2 O MoO 3 + 2KOH → K 2 MoO 4 + H 2 O WO 3 + 2NaOH → Na 2 WO 4 + H 2 O Como regla, los óxidos ácidos son óxidos no metálicos y óxidos metálicos en sus estados de oxidación más altos posibles. Si un elemento dado forma varios óxidos en diferentes estados de oxidación, como por ejemplo el cromo, las propiedades ácidas de sus óxidos aumentan con el aumento de su estado de oxidación:
- el óxido de cromo (II) CrO es alcalino,
- el óxido de cromo (III) Cr 2 O 3 tiene propiedades anfóteras,
- el óxido de cromo (VI) CrO 3 es ácido.

- Los óxidos alcalinos son aquellos compuestos de oxígeno con metales que reaccionan con ácidos para dar productos en forma de las sales correspondientes. Algunos de ellos, es decir, los óxidos de elementos del primer y segundo grupo de la tabla periódica, excluyendo el berilio, también se caracterizan por una reacción con el agua que da como resultado la formación de hidróxidos alcalinos. Ocurre, por ejemplo, durante la reacción de óxido de sodio, óxido de litio y óxido de bario con agua:
Na 2 O + H 2 O → 2NaOH Li 2 O + H 2 O → 2LiOH BaO + H 2 O → Ba(OH) 2 También hay óxidos alcalinos que no se disuelven en agua sino solo en soluciones ácidas. Estos incluyen, por ejemplo, óxido de manganeso (II) y óxido de hierro (II): MnO + H 2 SO 4 → MnSO 4 + H 2 O FeO + 2HCl → FeCl 2 + H 2 O
- Los óxidos neutros son el grupo de óxidos menos reactivo. No reaccionan ni con ácidos ni con álcalis. También son insolubles en agua. Ejemplos de este grupo de óxidos son el monóxido de carbono (II) CO y el óxido nítrico (II) NO.
- Los óxidos anfóteros son todo lo contrario de los óxidos neutros y son ácidos y alcalinos al mismo tiempo. Esto significa que reaccionan tanto con álcalis fuertes como con ácidos. Los productos de estas reacciones son siempre sales, y el elemento que se combina inicialmente con el oxígeno se transforma en un catión o anión apropiado del residuo ácido. La única similitud con los óxidos neutros es su escasa solubilidad en agua. Ejemplos de óxidos anfóteros son: óxido de berilio BeO, óxido de aluminio Al 2 O 3 , óxido de cromo (III), óxido de estaño (II) SnO, óxido de plomo (II) PbO y óxido de zinc ZnO. Al reaccionar con soluciones acuosas de álcalis fuertes, por ejemplo, con una solución acuosa de hidróxido de sodio , forman sales complejas . En sus residuos ácidos, los átomos o iones del metal que se deriva del óxido están presentes en complejos con un número apropiado de grupos hidroxilo. Su número depende del número de coordinación del elemento dado. Por ejemplo, los átomos derivados de óxidos MO (M – metal), como el óxido de berilio BeO, tienen el número de coordinación 4. Los átomos derivados de óxidos de tipo M 2 O 3 , por ejemplo, Al 2 O 3 , pueden tener dos números de coordinación diferentes, y dependiendo de las condiciones de reacción es 4 o 6. Ejemplos de reacciones de óxidos anfóteros:
BeO + 2HCl → BeCl 2 + H 2 O BeO + 2NaOH + H 2 O → Na 2 [Be (OH) 4] tetrahidroxi zincato de sodio Al 2 O 3 + 6HCl → 2AlCl 3 + 3H 2 O Al 2 O 3 + 2KOH + 3H 2 O → 2K[Al (OH) 4] tetrahidroxialuminato de potasio Al 2 O 3 + 6NaOH + 3H 2 O → 2Na 3 [Al (OH) 6] hexahidroxialuminato de sodio Algunos óxidos , como el óxido de zinc y el óxido de manganeso (IV), tienen propiedades anfóteras bastante específicas. Este último, ni en condiciones normales ni estándar, no reacciona con los álcalis. Ambos, por otro lado, reaccionan con ellos al fusionarse con álcalis sólidos, por ejemplo: 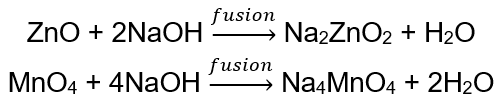

Obtención de óxidos
- Síntesis directa de elementos: a) síntesis de átomos de azufre y átomos de oxígeno con formación de óxido de azufre (IV) S + O → SO 2 b) síntesis de átomos de magnesio y átomos de oxígeno con formación de óxido de magnesio 2Mg + O 2 → 2MgO c) síntesis de átomos de carbono y átomos de oxígeno con la formación de monóxido de carbono (IV) C + O 2 → CO 2
- Descomposición térmica de sales , hidróxidos y óxidos: a) descomposición del carbonato de calcio en óxido de calcio y monóxido de carbono (IV) CaCO 3 → CaO + CO 2 b) descomposición del hidróxido de cobre (II) en óxido de cobre (II) y agua Cu( OH) 2 → CuO + H 2 O c) descomposición del óxido de manganeso (IV) en óxido de manganeso (III) y oxígeno 4MnO 2 → 2Mn 2 O 3 + O 2
- Oxidación de óxidos en estados de oxidación inferiores, con aumento de su valencia: a) oxidación de óxido de azufre (IV) a óxido de azufre (VI) 2SO 2 + O 2 → 2SO 3 b) oxidación de óxido nítrico (II) a nítrico ( IV) óxido 2NO + O 2 → 2NO 2 c) oxidación de monóxido de carbono (II) a monóxido de carbono (IV) (IV) 2CO + O 2 → 2CO 2
- Reducción de óxidos en estados de oxidación superiores, con disminución de su valencia: a) reducción de monóxido de carbono (IV) a monóxido de carbono (II) (II) CO 2 + C → 2CO b) reducción de óxido de estaño (II) a estaño (I) óxido 2SnO + O 2 → 2SnO 2
- Combustión de compuestos orgánicos: a) combustión de metano en oxígeno con formación de monóxido de carbono (IV) y agua CH 4 + 2O 2 → CO 2 + 2H 2 O b) combustión de amoníaco en oxígeno para obtener óxido nítrico (II) y agua 4NH 3 + 5O 2 → 4NO + 6H 2 O
- Reacción de oxiácidos inestables: a) descomposición del ácido carbónico (IV) en monóxido de carbono (IV) y agua: H 2 CO 3 → CO 2 + H 2 O b) descomposición del ácido sulfúrico (IV) en óxido de azufre (IV) y agua: H 2 SO 3 → SO 2 + H 2 O

