Jedná se o skupinu anorganických sloučenin, která vzniká spojením různých prvků s kyslíkem. Jejich obecný vzorec je X n O m , kde "X" je libovolný prvek, "O" je kyslík, vždy ve druhém oxidačním stavu, a písmena "n,m" v dolním indexu jsou koeficienty. Příklady oxidů: voda H 2 O, oxid draselný K 2 O, oxid hlinitý Al 2 O 3 , oxid vápenatý CaO a oxid uhelnatý CO.

Klasifikace oxidů
Oxidy lze rozdělit do několika kategorií. Nejobecnější klasifikací je rozlišení mezi oxidy kovů, např. oxid lithný, oxid hořečnatý, oxid hlinitý, oxid železa, a oxidy nekovů, včetně oxidu uhlíku, oxidu dusíku, oxidu síry a oxidu chloru . Dalším kritériem je klasifikace podle jejich fyzického stavu. Téměř všechny oxidy kovů a některé nekovy (SiO 2 , P 4 O 10 ) jsou pevné látky. Voda, oxid sírový (VI) a oxid mangan (VII) jsou kapaliny. Oxidy nekovů jako CO, CO 2 , SO 2 , NO i NO 2 jsou plyny. Oxidy lze také klasifikovat podle typu vazeb, které se v nich vyskytují. Oxid hořečnatý MgO, oxid vápenatý CaO nebo oxid sodný Na 2 O obsahují ionty O 2- a iontové vazby, odtud jejich název – iontové oxidy. Další skupinou jsou kovalentní oxidy, např. oxid uhelnatý CO, oxid dusnatý NO nebo oxid síry SO 2 , u kterých má vazba mezi atomem kyslíku a prvkem formu polární kovalentní vazby.
Chemický charakter oxidů
Pro chemiky je nejzajímavější klasifikace založená na chemické povaze oxidů. Existují čtyři hlavní kategorie oxidů – kyselé, zásadité, neutrální a amfoterní.
- Kyselé oxidy , někdy také nazývané anhydridy kyselin, se vyznačují tím, že reagují s alkáliemi za vzniku soli. Významná část kyselých oxidů tvoří po rozpuštění ve vodě vhodné roztoky oxykyselin . To platí např. pro oxid sírový (IV), který po rozpuštění ve vodě produkuje kyselinu sírovou (IV) , a pro oxid chromitý (VI), který se rozpouští na kyselinu chromitou (VI):
SO 2 + H 2 O → H 2 SO 3 CrO 3 + H 2 O → H 2 CrO 4 Existuje malá skupina kyselých oxidů, které jsou nerozpustné ve vodě. Jsou však rozpustné v roztocích silných alkálií , např. křemíku ( IV) oxid Si02 , oxid molybdenu (VI) Mo03 a oxid wolframu (VI) WO3 . Jejich reakce s alkáliemi potvrzují jejich kyselý charakter: SiO 2 + 2NaOH → Na 2 SiO 3 + H 2 O MoO 3 + 2KOH → K 2 MoO 4 + H 2 O WO 3 + 2NaOH → Na 2 WO 4 + H 2 O As a pravidlo, kyselé oxidy jsou oxidy nekovů a oxidy kovů v jejich nejvyšších možných oxidačních stavech. Pokud daný prvek tvoří několik oxidů v různých oxidačních stavech, jako je například chrom, kyselé vlastnosti jeho oxidů se zvyšují se zvyšováním jeho oxidačního stavu:
- oxid chromitý (II) CrO je alkalický,
- oxid chromitý Cr 2 O 3 má amfoterní vlastnosti,
- oxid chromitý CrO 3 je kyselý.

- Alkalické oxidy jsou ty sloučeniny kyslíku s kovy, které reagují s kyselinami za vzniku produktů ve formě odpovídajících solí. Některé z nich, tj. oxidy prvků z první a druhé skupiny periodické tabulky, vyjma berylia, se také vyznačují reakcí s vodou za vzniku alkalických hydroxidů. Vzniká např. při reakci oxidu sodného, oxidu lithného a oxidu barnatého s vodou:
Na 2 O + H 2 O → 2NaOH Li 2 O + H 2 O → 2LiOH BaO + H 2 O → Ba(OH) 2 Existují také alkalické oxidy, které se nerozpouštějí ve vodě, ale pouze v kyselých roztocích. Patří sem např. oxid manganatý (II) a oxid železitý: MnO + H 2 SO 4 → MnSO 4 + H 2 O FeO + 2HCl → FeCl 2 + H 2 O
- Neutrální oxidy jsou nejméně reaktivní skupinou oxidů. Nereagují s kyselinami ani zásadami. Jsou také nerozpustné ve vodě. Příklady této skupiny oxidů jsou oxid uhelnatý (II) CO a oxid dusnatý (II) NO.
- Amfoterní oxidy jsou úplným opakem neutrálních oxidů a jsou kyselé i zásadité zároveň. To znamená, že reagují se silnými zásadami i kyselinami. Produkty těchto reakcí jsou vždy soli a prvek, který je zpočátku spojen s kyslíkem, se přemění na vhodný kation nebo anion kyselého zbytku. Jedinou podobností s neutrálními oxidy je jejich špatná rozpustnost ve vodě. Příklady amfoterních oxidů jsou: oxid berylnatý BeO, oxid hlinitý Al203 , oxid chromitý, oxid cínatý SnO, oxid olovnatý PbO a oxid zinečnatý ZnO. Reakcí s vodnými roztoky silných alkálií, např. s vodným roztokem hydroxidu sodného , tvoří komplexní soli . Ve svých kyselých zbytcích jsou atomy nebo ionty kovu, který je odvozen od oxidu, přítomny v komplexech s příslušným počtem hydroxylových skupin. Jejich počet závisí na koordinačním čísle daného prvku. Například atomy odvozené od oxidů MO (M – metal), jako je oxid beryllitý BeO, mají koordinační číslo 4. Atomy odvozené od oxidů typu M 2 O 3 , např. Al 2 O 3 , mohou mít dvě různá koordinační čísla a v závislosti na reakčních podmínkách je to 4 nebo 6. Příklady reakcí amfoterních oxidů:
BeO + 2HCl → BeCl 2 + H 2 O BeO + 2NaOH + H 2 O → Na 2 [Be (OH) 4] tetrahydroxyzinekát sodný Al 2 O 3 + 6HCl → 2AlCl 3 + 3H 2 O Al 2 O 3 + 2KOH + 3H 2 O → 2K[Al (OH) 4] tetrahydroxyaluminát draselný Al 2 O 3 + 6NaOH + 3H 2 O → 2Na 3 [Al (OH) 6] hexahydroxyaluminát sodný Některé oxidy , jako je oxid zinečnatý a oxid manganitý, mají zcela specifické amfoterní vlastnosti. Ten za normálních ani standardních podmínek nereaguje s alkáliemi. Oba s nimi naopak reagují tavením s pevnými alkáliemi, např.: 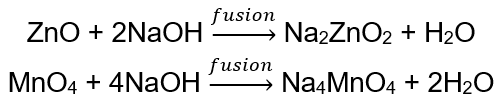

Získávání oxidů
- Přímá syntéza prvků: a) syntéza atomů síry a atomů kyslíku za vzniku oxidu sírového (IV) S + O → SO 2 b) syntéza atomů hořčíku a atomů kyslíku za vzniku oxidu hořečnatého 2Mg + O 2 → 2MgO c) syntéza atomů uhlíku a atomů kyslíku za vzniku oxidu uhelnatého C + O 2 → CO 2
- Tepelný rozklad solí , hydroxidů a oxidů: a) rozklad uhličitanu vápenatého na oxid vápenatý a oxid uhelnatý CaCO 3 → CaO + CO 2 b) rozklad hydroxidu měďnatého na oxid měďnatý a vodu Cu( OH) 2 → CuO + H 2 O c) rozklad oxidu manganatého na oxid manganatý a kyslík 4MnO 2 → 2Mn 2 O 3 + O 2
- Oxidace oxidů v nižších oxidačních stavech, se zvýšením jejich mocenství: a) oxidace oxidu sírového (IV) na oxid sírový (VI) oxid 2SO 2 + O 2 → 2SO 3 b) oxidace oxidu dusnatého (II) na dusičnatý ( IV) oxid 2NO + O 2 → 2NO 2 c) oxidace oxidu uhelnatého (II) na oxid uhelnatý (IV) 2CO + O 2 → 2CO 2
- Redukce oxidů při vyšších oxidačních stavech, se snížením jejich mocenství: a) redukce oxidu uhelnatého na oxid uhelnatý (II) CO 2 + C → 2CO b) redukce oxidu cínatého na cín (I) oxid 2SnO + O 2 → 2SnO 2
- Spalování organických sloučenin: a) spalování metanu v kyslíku za vzniku oxidu uhelnatého (IV) a vody CH 4 + 2O 2 → CO 2 + 2H 2 O b) spalování amoniaku v kyslíku za vzniku oxidu dusnatého (II) resp. voda 4NH3 + 5O2 → 4NO + 6H20
- Reakce nestabilních oxykyselin: a) rozklad kyseliny uhličité (IV) na oxid uhelnatý a vodu: H 2 CO 3 → CO 2 + H 2 O b) rozklad kyseliny sírové (IV) na oxid sírový (IV) a voda : H2SO3 → SO2 + H20

