Ide o skupinu anorganických zlúčenín vytvorených kombináciou rôznych prvkov s kyslíkom. Ich všeobecný vzorec je XnOm , kde "X" je ľubovoľný prvok, "O" je kyslík, vždy v druhom oxidačnom stave, a písmená "n,m" v dolnom indexe sú koeficienty. Príklady oxidov: voda H 2 O, oxid draselný K 2 O, oxid hlinitý Al 2 O 3 , oxid vápenatý CaO a oxid uhoľnatý CO.

Klasifikácia oxidov
Oxidy možno rozdeliť do niekoľkých kategórií. Najvšeobecnejšou klasifikáciou je rozlíšenie medzi oxidmi kovov, napr. oxid lítny, oxid horečnatý, oxid hlinitý, oxid železa, a oxidy nekovov, vrátane oxidu uhlíka, oxidu dusíka, oxidu síry a oxidu chlóru . Ďalším kritériom je klasifikácia podľa ich fyzického stavu. Takmer všetky oxidy kovov a niektoré nekovy (SiO 2 , P 4 O 10 ) sú pevné látky. Voda, oxid síry (VI) a oxid mangánu (VII) sú kvapaliny. Oxidy nekovov ako CO, CO 2 , SO 2 , NO i NO 2 sú plyny. Oxidy možno klasifikovať aj podľa typu väzieb, ktoré sa v nich vyskytujú. Oxid horečnatý MgO, oxid vápenatý CaO alebo oxid sodný Na 2 O obsahujú ióny O 2- a iónové väzby, odtiaľ ich názov – iónové oxidy. Ďalšou skupinou sú kovalentné oxidy, napr. oxid uhoľnatý CO, oxid dusnatý NO alebo oxid síry (IV) SO 2 , v ktorých má väzba medzi atómom kyslíka a prvkom formu polárnej kovalentnej väzby.
Chemický charakter oxidov
Pre chemikov je najzaujímavejšia klasifikácia založená na chemickej povahe oxidov. Existujú štyri hlavné kategórie oxidov – kyslé, zásadité, neutrálne a amfotérne.
- Kyslé oxidy , niekedy tiež nazývané anhydridy kyselín, sa vyznačujú tým, že reagujú s alkáliami za tvorby solí. Významná časť kyslých oxidov tvorí po rozpustení vo vode vhodné roztoky kyslých kyselín . Platí to napríklad pre oxid sírový (IV), ktorý po rozpustení vo vode produkuje kyselinu sírovú (IV) a pre oxid chrómový (VI), ktorý sa rozpúšťa na kyselinu chrómovú (VI):
SO 2 + H 2 O → H 2 SO 3 CrO 3 + H 2 O → H 2 CrO 4 Existuje malá skupina kyslých oxidov, ktoré sú nerozpustné vo vode. Sú však rozpustné v roztokoch silných zásad , napr. IV) oxid Si02 , oxid molybdénový (VI) Mo03 a oxid volfrámu (VI) WO3 . Ich reakcie s alkáliami potvrdzujú ich kyslý charakter: SiO 2 + 2NaOH → Na 2 SiO 3 + H 2 O MoO 3 + 2KOH → K 2 MoO 4 + H 2 O WO 3 + 2NaOH → Na 2 WO 4 + H 2 O As a pravidlom, kyslé oxidy sú oxidy nekovov a oxidy kovov v ich najvyšších možných oxidačných stavoch. Ak daný prvok tvorí niekoľko oxidov v rôznych oxidačných stupňoch, ako je napríklad chróm, kyslé vlastnosti jeho oxidov sa zvyšujú so zvyšovaním jeho oxidačného stavu:
- oxid chrómu (II) CrO je alkalický,
- oxid chromitý Cr 2 O 3 má amfotérne vlastnosti,
- oxid chromitý CrO 3 je kyslý.

- Alkalické oxidy sú zlúčeniny kyslíka s kovmi, ktoré reagujú s kyselinami za vzniku produktov vo forme zodpovedajúcich solí. Niektoré z nich, tj oxidy prvkov z prvej a druhej skupiny periodickej tabuľky, okrem berýlia, sa vyznačujú aj reakciou s vodou, pri ktorej vznikajú alkalické hydroxidy. Vyskytuje sa napríklad pri reakcii oxidu sodného, oxidu lítneho a oxidu bárnatého s vodou:
Na 2 O + H 2 O → 2NaOH Li 2 O + H 2 O → 2LiOH BaO + H 2 O → Ba(OH) 2 Existujú aj alkalické oxidy, ktoré sa nerozpúšťajú vo vode, ale len v kyslých roztokoch. Patria sem napr. oxid mangánu (II) a oxid železa (II): MnO + H 2 SO 4 → MnSO 4 + H 2 O FeO + 2HCl → FeCl 2 + H 2 O
- Neutrálne oxidy sú najmenej reaktívnou skupinou oxidov. Nereagujú s kyselinami ani zásadami. Sú tiež nerozpustné vo vode. Príkladmi tejto skupiny oxidov sú oxid uhoľnatý (CO) a oxid dusnatý (II) NO.
- Amfotérne oxidy sú úplným opakom neutrálnych oxidov a sú kyslé aj zásadité súčasne. To znamená, že reagujú so silnými zásadami aj kyselinami. Produkty týchto reakcií sú vždy soli a prvok, ktorý je na začiatku spojený s kyslíkom, sa premení na vhodný katión alebo anión zvyšku kyseliny. Jediná podobnosť s neutrálnymi oxidmi je ich slabá rozpustnosť vo vode. Príklady amfotérnych oxidov sú: oxid berýlia BeO, oxid hlinitý Al203 , oxid chromitý, oxid cínatý SnO, oxid olovnatý PbO a oxid zinočnatý ZnO. Reakciou s vodnými roztokmi silných zásad, napr. s vodným roztokom hydroxidu sodného , tvoria komplexné soli . Vo svojich kyslých zvyškoch sú atómy alebo ióny kovu, ktorý je odvodený od oxidu, prítomné v komplexoch s príslušným počtom hydroxylových skupín. Ich počet závisí od koordinačného čísla daného prvku. Napríklad atómy odvodené od oxidov MO (M – kov), ako je oxid berýlia BeO, majú koordinačné číslo 4. Atómy odvodené od oxidov typu M 2 O 3 , napr. Al 2 O 3 , môžu mať dve rôzne koordinačné čísla a v závislosti od reakčných podmienok je to 4 alebo 6. Príklady reakcií amfotérnych oxidov:
BeO + 2HCl → BeCl 2 + H 2 O BeO + 2NaOH + H 2 O → Na 2 [Be (OH) 4] tetrahydroxyzinekát sodný Al 2 O 3 + 6HCl → 2AlCl 3 + 3H 2 O Al 2 O 3 + 2KOH + 3H 2 O → 2K[Al (OH) 4] tetrahydroxyaluminát draselný Al 2 O 3 + 6NaOH + 3H 2 O → 2Na 3 [Al (OH) 6] hexahydroxyaluminát sodný Niektoré oxidy , ako je oxid zinočnatý a oxid mangánu (IV), majú celkom špecifické amfotérne vlastnosti. Ten za normálnych ani štandardných podmienok nereaguje s alkáliami. Obidve s nimi na druhej strane reagujú tavením s pevnými zásadami, napr. 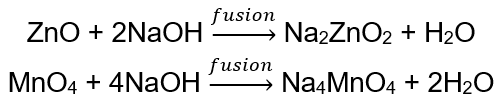

Získavanie oxidov
- Priama syntéza prvkov: a) syntéza atómov síry a atómov kyslíka za vzniku oxidu sírového (IV) S + O → SO 2 b) syntéza atómov horčíka a atómov kyslíka za vzniku oxidu horečnatého 2Mg + O 2 → 2MgO c) syntéza atómov uhlíka a atómov kyslíka za vzniku oxidu uhoľnatého C + O 2 → CO 2
- Tepelný rozklad solí , hydroxidov a oxidov: a) rozklad uhličitanu vápenatého na oxid vápenatý a oxid uhoľnatý CaCO 3 → CaO + CO 2 b) rozklad hydroxidu meďnatého na oxid meďnatý a vodu Cu( OH) 2 → CuO + H 2 O c) rozklad oxidu mangánu (IV) na oxid mangánu (III) a kyslík 4MnO 2 → 2Mn 2 O 3 + O 2
- Oxidácia oxidov v nižších oxidačných stupňoch, so zvýšením ich mocenstva: a) oxidácia oxidu sírového (IV) na oxid sírový (VI) oxid 2SO 2 + O 2 → 2SO 3 b) oxidácia oxidu dusnatého (II) na dusnatý ( IV) oxid 2NO + O 2 → 2NO 2 c) oxidácia oxidu uhoľnatého na oxid uhoľnatý (IV) 2CO + O 2 → 2CO 2
- Redukcia oxidov vo vyšších oxidačných stupňoch, so znížením ich mocnosti: a) redukcia oxidu uhoľnatého na oxid uhoľnatý (II) CO 2 + C → 2CO b) redukcia oxidu cínatého na cín (I) oxid 2SnO + O 2 → 2SnO 2
- Spaľovanie organických zlúčenín: a) spaľovanie metánu v kyslíku za vzniku oxidu uhoľnatého (IV) a vody CH 4 + 2O 2 → CO 2 + 2H 2 O b) spaľovanie amoniaku v kyslíku za vzniku oxidu dusnatého (II) resp. voda 4NH3 + 502 -> 4NO + 6H20
- Reakcia nestabilných kyslých kyselín: a) rozklad kyseliny uhličitej (IV) na oxid uhoľnatý a vodu: H 2 CO 3 → CO 2 + H 2 O b) rozklad kyseliny sírovej (IV) na oxid sírový a voda : H2SO3 -> SO2 + H20

