Dit is een groep anorganische verbindingen die wordt gevormd door de combinatie van verschillende elementen met zuurstof. Hun algemene formule is X n O m , waarbij "X" elk element is, "O" zuurstof is, altijd in de tweede oxidatietoestand, en de letters "n,m" in de onderste index coëfficiënten zijn. Voorbeelden van oxiden: water H 2 O, kaliumoxide K 2 O, aluminiumoxide Al 2 O 3 , calciumoxide CaO en koolstof(II)monoxide CO.

Classificatie van oxiden
Oxiden kunnen in verschillende categorieën worden ingedeeld. De meest algemene classificatie is het onderscheid tussen metaaloxiden, bijvoorbeeld lithiumoxide, magnesiumoxide, aluminiumoxide, ijzeroxide en niet-metaaloxiden, waaronder koolstofoxide, stikstofoxide, zwaveloxide en chlooroxide . Een ander criterium is de classificatie op basis van hun fysieke toestand. Bijna alle metaaloxiden en sommige niet-metalen (SiO 2 , P 4 O 10 ) zijn vaste stoffen. Water, zwavel(VI)oxide en mangaan(VII)oxide zijn vloeistoffen. Niet-metaaloxiden zoals CO, CO 2 , SO 2 , NO i NO 2 zijn gassen. Oxiden kunnen ook worden geclassificeerd op basis van het type bindingen dat erin voorkomt. Magnesiumoxide MgO, calciumoxide CaO of natriumoxide Na 2 O bevatten O 2- ionen en ionische bindingen, vandaar hun naam – ionische oxiden. Een andere groep zijn covalente oxiden, bijvoorbeeld koolstof(II)monoxide CO, stikstof(II)oxide NO of zwavel(IV)oxide SO 2 , waarin de binding tussen het zuurstofatoom en het element de vorm heeft van een polaire covalente binding.
Het chemische karakter van oxiden
Voor chemici is de meest interessante classificatie gebaseerd op de chemische aard van oxiden. Er zijn vier hoofdcategorieën van oxiden: zuur, basisch, neutraal en amfoteer.
- Zure oxiden , soms ook zuuranhydriden genoemd, onderscheiden zich door het feit dat ze reageren met basen onder vorming van zout. Een aanzienlijk deel van de zure oxiden vormt na oplossing in water geschikte oplossingen van oxyzuren . Dit geldt bijvoorbeeld voor zwavel(IV)oxide, dat bij oplossen in water zwavelzuur (IV)zuur produceert, en voor chroom(VI)oxide dat oplost tot chroom(VI)zuur:
SO 2 + H 2 O → H 2 SO 3 CrO 3 + H 2 O → H 2 CrO 4 Er is een kleine groep zure oxiden die onoplosbaar zijn in water. Ze zijn echter wel oplosbaar in oplossingen van sterke basen , bijv. silicium ( IV) oxide Si02 , molybdeen (VI) oxide Mo03 en wolfraam (VI) oxide WO3 . Hun reacties met basen bevestigen hun zure karakter: SiO 2 + 2NaOH → Na 2 SiO 3 + H 2 O MoO 3 + 2KOH → K 2 MoO 4 + H 2 O WO 3 + 2NaOH → Na 2 WO 4 + H 2 O Als regel, zure oxiden zijn niet-metaaloxiden en metaaloxiden in hun hoogst mogelijke oxidatietoestanden. Als een bepaald element verschillende oxiden vormt in verschillende oxidatietoestanden, zoals bijvoorbeeld chroom, nemen de zure eigenschappen van de oxiden toe met de toename van de oxidatietoestand:
- chroom (II) CrO-oxide is alkalisch,
- chroom(III)oxide Cr 2 O 3 heeft amfotere eigenschappen,
- chroom(VI)oxide CrO 3 is zuur.

- Alkalische oxiden zijn die verbindingen van zuurstof met metalen die reageren met zuren om producten te geven in de vorm van de overeenkomstige zouten. Sommige daarvan, dwz oxiden van elementen uit de eerste en tweede groep van het periodiek systeem, met uitzondering van beryllium, worden ook gekenmerkt door een reactie met water die resulteert in de vorming van alkalische hydroxiden. Het ontstaat bijvoorbeeld bij de reactie van natriumoxide, lithiumoxide en bariumoxide met water:
Na 2 O + H 2 O → 2NaOH Li 2 O + H 2 O → 2LiOH BaO + H 2 O → Ba(OH) 2 Er zijn ook alkalische oxiden die niet oplossen in water maar alleen in zure oplossingen. Dit zijn bijvoorbeeld mangaan(II)oxide en ijzer(II)oxide: MnO + H 2 SO 4 → MnSO 4 + H 2 O FeO + 2HCl → FeCl 2 + H 2 O
- Neutrale oxiden zijn de minst reactieve groep oxiden. Ze reageren niet met zuren of basen. Ze zijn ook onoplosbaar in water. Voorbeelden van deze groep oxiden zijn koolstof(II)monoxide CO en stikstof(II)oxide NO.
- Amfotere oxiden zijn het tegenovergestelde van neutrale oxiden en zijn tegelijkertijd zowel zuur als alkalisch. Dit betekent dat ze reageren met zowel sterke basen als zuren. De producten van deze reacties zijn altijd zouten en het element dat in eerste instantie wordt gecombineerd met zuurstof wordt omgezet in een geschikt kation of anion van het zuurresidu. De enige overeenkomst met neutrale oxiden is hun slechte oplosbaarheid in water. Voorbeelden van amfotere oxiden zijn: berylliumoxide BeO, aluminiumoxide Al 2 O 3 , chroom(III)oxide, tin(II)oxide SnO, lood(II)oxide PbO en zinkoxide ZnO. Door te reageren met waterige oplossingen van sterke basen, bijvoorbeeld met een waterige oplossing van natriumhydroxide , vormen ze complexe zouten . In hun zuurresten zijn atomen of ionen van het metaal, dat is afgeleid van het oxide, aanwezig in complexen met een geschikt aantal hydroxylgroepen. Hun aantal hangt af van het coördinatiegetal van het gegeven element. Bijvoorbeeld, atomen afgeleid van MO (M – metaal) oxiden, zoals berylliumoxide BeO, hebben het coördinatiegetal 4. Atomen afgeleid van M 2 O 3 type oxiden, bijv. Al 2 O 3 , kunnen twee verschillende coördinatiegetallen hebben, en afhankelijk van de reactieomstandigheden is het 4 of 6. Voorbeeldreacties van amfotere oxiden:
BeO + 2HCl → BeCl 2 + H 2 O BeO + 2NaOH + H 2 O → Na 2 [Be (OH) 4] natriumtetrahydroxyzinaat Al 2 O 3 + 6HCl → 2AlCl 3 + 3H 2 O Al 2 O 3 + 2KOH + 3H 2 O → 2K[Al (OH) 4] kaliumtetrahydroxyaluminaat Al 2 O 3 + 6NaOH + 3H 2 O → 2Na 3 [Al (OH) 6] natriumhexahydroxyaluminaat Sommige oxiden , zoals zinkoxide en mangaan (IV) oxide, hebben vrij specifieke amfotere eigenschappen. Dit laatste reageert, noch onder normale noch standaardomstandigheden, niet met alkaliën. Beide daarentegen reageren ermee door te versmelten met vaste basen, bijvoorbeeld: 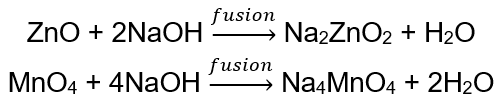

Oxiden verkrijgen
- Directe synthese van elementen: a) synthese van zwavelatomen en zuurstofatomen met vorming van zwavel(IV)oxide S + O → SO 2 b) synthese van magnesiumatomen en zuurstofatomen met vorming van magnesiumoxide 2Mg + O 2 → 2MgO c) synthese van koolstofatomen en zuurstofatomen met vorming van koolstof(IV)monoxide C + O 2 → CO 2
- Thermische ontleding van zouten , hydroxiden en oxiden: a) ontleding van calciumcarbonaat in calciumoxide en koolstof(IV)monoxide CaCO 3 → CaO + CO 2 b) ontleding van koper(II)hydroxide in koper(II)oxide en water Cu( OH) 2 → CuO + H 2 O c) ontleding van mangaan(IV)oxide in mangaan(III)oxide en zuurstof 4MnO 2 → 2Mn 2 O 3 + O 2
- Oxidatie van oxiden in lagere oxidatietoestanden, met een toename van hun valentie: a) oxidatie van zwavel (IV) oxide tot zwavel (VI) oxide 2SO 2 + O 2 → 2SO 3 b) oxidatie van stikstof (II) oxide tot stikstof ( IV) oxide 2NO + O 2 → 2NO 2 c) oxidatie van koolstof (II) monoxide tot koolstof (IV) monoxide (IV) 2CO + O 2 → 2CO 2
- Reductie van oxiden bij hogere oxidatietoestanden, met afname van hun valentie: a) reductie van koolstof(IV)monoxide tot koolstof(II)monoxide(II) CO 2 + C → 2CO b) reductie van tin(II)oxide tot tin (I) oxide 2SnO + O 2 → 2SnO 2
- Verbranding van organische verbindingen: a) verbranding van methaan in zuurstof met vorming van koolstof(IV)monoxide en water CH 4 + 2O 2 → CO 2 + 2H 2 O b) verbranding van ammoniak in zuurstof om stikstof(II)oxide te verkrijgen en water 4NH 3 + 5O 2 → 4NO + 6H 2 O
- Reactie van onstabiele oxyzuren: a) ontleding van koolzuur(IV)zuur in koolstof(IV)monoxide en water: H 2CO 3 → CO 2 + H 2O b) ontleding van zwavelzuur(IV)zuur in zwavel(IV)oxide en water: H 2 SO 3 → SO 2 + H 2 O

