이것은 다양한 원소와 산소가 결합하여 형성된 무기 화합물 그룹입니다. 일반 공식은 X n O m 이며 여기서 "X"는 임의의 원소이고 "O"는 항상 두 번째 산화 상태에 있는 산소이며 낮은 지수의 문자 "n,m"은 계수입니다. 산화물의 예: 물 H 2 O, 산화칼륨 K 2 O, 산화알루미늄 Al 2 O 3 , 산화칼슘 CaO 및 일산화탄소(II) CO.

산화물의 분류
산화물은 여러 범주로 분류할 수 있습니다. 가장 일반적인 분류는 산화 리튬, 산화 마그네슘, 산화 알루미늄, 산화 철과 같은 금속 산화물과 탄소 산화물, 질소 산화물, 황산화물 및 염소 산화물을 포함한 비금속 산화물 사이의 구별입니다. 또 다른 기준은 신체 상태에 따른 분류입니다. 거의 모든 금속 산화물과 일부 비금속(SiO 2 , P 4 O 10 )은 고체입니다. 물, 산화황(VI) 및 산화망간(VII)은 액체입니다. CO, CO 2 , SO 2 , NO i NO 2 와 같은 비금속 산화물은 가스입니다. 산화물은 또한 산화물에서 발생하는 결합 유형에 따라 분류할 수 있습니다. 산화 마그네슘 MgO, 산화 칼슘 CaO 또는 산화 나트륨 Na 2 O는 O 2- 이온과 이온 결합을 포함하므로 이름은 이온 산화물입니다. 또 다른 그룹은 공유 산화물, 예를 들어 일산화탄소(II) CO, 산화질소(II) NO 또는 산화황(IV) SO2 이며, 여기서 산소 원자와 원소 사이의 결합은 극성 공유 결합의 형태를 갖는다.
산화물의 화학적 특성
화학자들에게 가장 흥미로운 분류는 산화물의 화학적 성질을 기반으로 합니다. 산화물에는 산성, 염기성, 중성 및 양성의 네 가지 주요 범주가 있습니다.
- 때때로 산 무수물이라고도 하는 산성 산화물은 알칼리와 반응하여 염을 형성한다는 점에서 구별됩니다. 산성 산화물의 상당 부분은 물에 용해된 후 산소산 의 적절한 용액을 형성합니다. 이는 예를 들어 물에 용해될 때 황산(IV )산을 생성하는 산화황(IV ) 및 크롬(VI)산에 용해되는 산화크롬(VI)에 적용됩니다.
SO 2 + H 2 O → H 2 SO 3 CrO 3 + H 2 O → H 2 CrO 4 물에 녹지 않는 작은 그룹의 산성 산화물이 있습니다. 그러나 강알칼리 용액 , 예를 들어 실리콘( IV) 산화물 SiO 2 , 몰리브덴(VI) 산화물 MoO 3 및 텅스텐(VI) 산화물 WO 3 . 알칼리와의 반응은 산성 특성을 확인합니다: SiO 2 + 2NaOH → Na 2 SiO 3 + H 2 O MoO 3 + 2KOH → K 2 MoO 4 + H 2 O WO 3 + 2NaOH → Na 2 WO 4 + H 2 O 일반적으로 산성 산화물은 가능한 가장 높은 산화 상태의 비금속 산화물 및 금속 산화물입니다. 주어진 원소가 예를 들어 크롬과 같이 서로 다른 산화 상태에서 여러 산화물을 형성하는 경우 산화 상태가 증가함에 따라 산화물의 산성 특성이 증가합니다.
- 크롬(II) Cr2O 산화물은 알칼리성이며,
- 크롬 (III) 산화물 Cr 2 O 3 은 양쪽 성 특성을 가지며,
- 크롬(VI) 산화물 CrO3 는 산성입니다.

- 알칼리성 산화물은 산과 반응하여 해당 염의 형태로 생성물을 제공하는 금속과 산소의 화합물입니다. 그들 중 일부, 즉 베릴륨을 제외한 주기율표의 첫 번째 및 두 번째 그룹의 원소 산화물은 또한 알칼리성 수산화물을 형성하는 물과의 반응을 특징으로 합니다. 예를 들어 산화나트륨, 산화리튬 및 산화바륨이 물과 반응하는 동안 발생합니다.
Na 2 O + H 2 O → 2NaOH Li 2 O + H 2 O → 2LiOH BaO + H 2 O → Ba(OH) 2 물에는 녹지 않고 산 용액에만 녹는 알칼리성 산화물도 있습니다. 이들은 예를 들어 망간(II) 산화물 및 철(II) 산화물을 포함한다: MnO + H 2 SO 4 → MnSO 4 + H 2 O FeO + 2HCl → FeCl 2 + H 2 O
- 중성 산화물은 반응성이 가장 낮은 산화물 그룹입니다. 그들은 산이나 알칼리와 반응하지 않습니다. 또한 물에 녹지 않습니다. 이 산화물 그룹의 예는 일산화탄소(II) CO 및 산화질소(II) NO입니다.
- 양쪽성 산화물은 중성 산화물의 완전한 반대이며 동시에 산성 및 알칼리성입니다. 이것은 그들이 강 알칼리 및 산 모두와 반응한다는 것을 의미합니다. 이러한 반응의 생성물은 항상 염이며 초기에 산소와 결합한 원소는 산 잔기의 적절한 양이온 또는 음이온으로 변환됩니다. 중성 산화물과 유일한 유사점은 물에 대한 용해도가 낮다는 것입니다. 양쪽성 산화물 의 예는 산화베릴륨 BeO, 산화알루미늄 Al2O3 , 산화크롬(III), 산화주석(II) SnO, 산화납(II) PbO 및 산화아연 ZnO이다. 예를 들어 수산화나트륨 수용액과 같은 강알칼리 수용액과 반응하여 착염을 형성합니다. 산 잔기에는 산화물에서 파생된 금속의 원자 또는 이온이 적절한 수의 수산기와 착물 형태로 존재합니다. 그들의 수는 주어진 요소의 배위 수에 따라 다릅니다. 예를 들어, 베릴륨 산화물 BeO와 같은 MO(M – 금속) 산화물에서 파생된 원자는 배위수 4를 갖습니다. 예를 들어 Al 2 O 3 와 같은 M 2 O 3 유형 산화물에서 파생된 원자는 두 개의 다른 배위수를 가질 수 있습니다. 반응 조건에 따라 4 또는 6입니다. 양쪽성 산화물의 반응 예:
BeO + 2HCl → BeCl 2 + H 2 O BeO + 2NaOH + H 2 O → Na 2 [Be(OH) 4] 나트륨 테트라히드록시 아연산염 Al 2 O 3 + 6HCl → 2AlCl 3 + 3H 2 O Al 2 O 3 + 2KOH + 3H 2 O → 2K[Al (OH) 4] 포타슘 테트라히드록시알루미네이트 Al 2 O 3 + 6NaOH + 3H 2 O → 2Na 3 [Al (OH) 6] 나트륨 헥사히드록시알루미네이트 일부 산화물 , 산화아연 및 망간(IV) 산화물과 같은 것은 매우 특정한 양쪽성 특성을 가지고 있습니다. 후자는 정상 또는 표준 조건에서 알칼리와 반응하지 않습니다. 반면에 둘 다 고체 알칼리와 융합하여 반응합니다. 예: 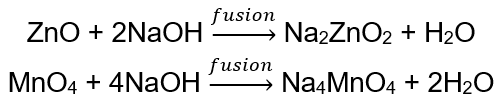

산화물 얻기
- 원소의 직접 합성 : a) 황 (IV) 산화물 S + O → SO 2 형성으로 황 원자 및 산소 원자 합성 b) 산화 마그네슘 2Mg + O 2 → 2MgO 형성으로 마그네슘 원자 및 산소 원자 합성 c) 일산화탄소(IV) C + O 2 → CO 2 의 형성과 함께 탄소 원자와 산소 원자의 합성
- 염 , 수산화물 및 산화물의 열분해: a) 탄산칼슘을 산화칼슘 및 일산화탄소(IV) CaCO 3 → CaO + CO 2 로 분해 b) 수산화구리(II)를 산화구리(II) 및 물 Cu( OH) 2 → CuO + H 2 O c) 망간(IV) 산화물의 분해 망간(III) 산화물 및 산소 4MnO 2 → 2Mn 2 O 3 + O 2
- 원자가가 증가하는 낮은 산화 상태에서 산화물의 산화: a) 황(IV) 산화물의 황(VI) 산화물로의 산화 2SO 2 + O 2 → 2SO 3 b) 산화질소(II)의 산화질소로의 산화( IV) 산화물 2NO + O 2 → 2NO 2 c) 일산화탄소(II)의 일산화탄소(IV)로의 산화(IV) 2CO + O 2 → 2CO 2
- 더 높은 산화 상태에서 산화물의 환원, 원자가 감소: a) 일산화탄소(IV)의 일산화탄소(II) 일산화탄소(II) CO 2 + C → 2CO b) 주석(II) 산화물의 주석으로의 환원 (I) 산화물 2SnO + O 2 → 2SnO 2
- 유기 화합물의 연소 : a) 일산화탄소 (IV)와 물 CH 4 + 2O 2 → CO 2 + 2H 2 O의 형성과 함께 산소에서 메탄 연소 b) 산화 질소 (II)를 얻기 위해 산소에서 암모니아 연소 및 물 4NH 3 + 5O 2 → 4NO + 6H 2 O
- 불안정한 옥시산의 반응: a) 탄산(IV) 산의 일산화탄소 (IV) 및 물로의 분해: H 2 CO 3 → CO 2 + H 2 O b) 황산(IV) 산의 황(IV) 산화물로의 분해 및 물: H 2 SO 3 → SO 2 + H 2 O

