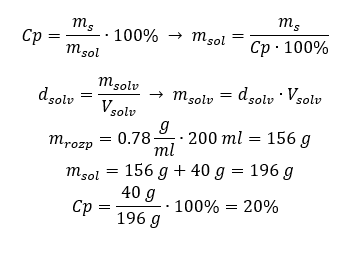ในวิชาเคมี เรามักจะใช้คำศัพท์ต่างๆ เช่น "สารละลายเข้มข้น" "สารละลายเจือจาง" หรือ "สารละลายอิ่มตัว" แต่คำเหล่านี้ให้เพียงโครงร่างพื้นฐานว่าสารละลายนั้นมีสารเฉพาะในปริมาณมากหรือน้อย อย่างไรก็ตาม มีวิธีการสองสามวิธีที่ช่วยให้เราระบุองค์ประกอบเชิงปริมาณของโซลูชันที่กำหนดได้อย่างแม่นยำ หนึ่งในนั้นจะกล่าวถึงในบทความต่อไปนี้

ความหมายของความเข้มข้นร้อยละ
คำว่า "ความเข้มข้น" หมายถึงการวัดปริมาณของสารที่กำหนดซึ่งมีอยู่ในสารละลายเฉพาะ ความเข้มข้นสามารถแสดงเป็นหน่วยตามหน่วยวัดที่เราใช้ เช่น เป็นโมล กรัม หรือเป็นเปอร์เซ็นต์ เปอร์เซ็นต์ความเข้มข้นบ่งชี้ว่าสารละลายมีกี่ส่วนโดยมวลที่รวมอยู่ในสารละลาย 100 ส่วนโดยมวล กล่าวอีกนัยหนึ่งคือจำนวนกรัมของตัวถูกละลายในสารละลาย 100 กรัม ตัวอย่างเช่น ถ้าเราซื้อนมที่มีฉลาก 3.2%หมายความว่านม 100 กรัมมีไขมัน 3.2 กรัม เปอร์เซ็นต์ความเข้มข้นเรียกโดยย่อว่า Cp
สูตรทั่วไปของความเข้มข้นร้อยละ
เพื่อให้ได้สูตรสำหรับความเข้มข้นร้อยละ เราต้องจำไว้ว่า มวลของสารละลาย (m sol ) ไม่เพียงแต่ประกอบด้วย มวลของตัวทำละลาย (m solv ) เท่านั้น แต่ยังรวมถึง มวลของตัวถูกละลายด้วย (m s ) : m sol = m solv + m s ตัวอย่างเช่น หากเราใช้สารละลาย 4%ที่มีมวล 100 g เราจะรู้ว่า Cp = 4%ดังนั้นมวลของสารคือ 4 g คำจำกัดความของความเข้มข้นเป็นเปอร์เซ็นต์บ่งชี้ว่าถ้ามวลของสารละลายเท่ากับ 100 กรัม มวลของตัวทำละลายจะเท่ากับ 96 กรัม เปอร์เซ็นต์ความเข้มข้นสามารถคำนวณได้ด้วยสูตรต่อไปนี้: Cp = (m s /m sol ) · 100%ดังที่เราเห็นจากสูตร หากเราทราบมวลของสารละลายและมวลของสาร เราสามารถคำนวณได้อย่างง่ายดาย เปอร์เซ็นต์ความเข้มข้น ตัวอย่างเช่น ถ้าเรารู้ว่าสารละลายหนัก 450 ก. และตัวถูกละลายหนัก 15 ก. จากนั้นใส่ตัวเลขเหล่านี้ลงในสูตร เราจะได้ค่าต่อไปนี้: Cp = (15/450) · 100%= 3.3%
การคำนวณมวลของส่วนผสมแต่ละชนิดในสารละลาย
แต่ละสูตรรวมถึงความเข้มข้นของเปอร์เซ็นต์สามารถจัดเรียงใหม่ได้ ถ้าเราทราบมวลและเปอร์เซ็นต์ความเข้มข้นของสารละลาย เราจะสามารถคำนวณมวลของตัวถูกละลายได้ ในทำนองเดียวกัน หากเราทราบเปอร์เซ็นต์ความเข้มข้นและมวลของสาร เราก็สามารถคำนวณมวลของสารละลายได้ นอกจากการจัดเรียงสูตรใหม่แล้วเรายังสามารถใช้สัดส่วนที่เหมาะสมได้อีกด้วย ตัวอย่างที่ 1 เราต้องใช้น้ำตาลกี่กรัมในการเตรียมสารละลาย 10%300 กรัม เราทราบจากคำแนะนำว่ามวลของสารละลายคือ 300 g และเปอร์เซ็นต์ความเข้มข้นคือ 10%สามารถหามวลของตัวถูกละลายได้สองวิธี วิธีที่ 1 จัดเรียงสูตรใหม่ 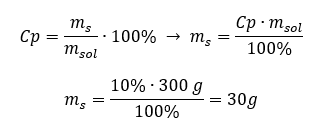 วิธีที่ 2 ใช้สัดส่วน โดยรู้ว่าสารละลาย 10%มีน้ำตาล 10 กรัมในสารละลาย 100 กรัม:
วิธีที่ 2 ใช้สัดส่วน โดยรู้ว่าสารละลาย 10%มีน้ำตาล 10 กรัมในสารละลาย 100 กรัม: 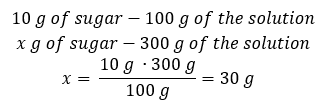 ทั้งสองวิธีจะนำเราไปสู่ข้อสรุปว่าการเตรียมสารละลาย 10%300 กรัมจะต้องใช้น้ำตาล 30 กรัม
ทั้งสองวิธีจะนำเราไปสู่ข้อสรุปว่าการเตรียมสารละลาย 10%300 กรัมจะต้องใช้น้ำตาล 30 กรัม  ตัวอย่างที่ 2 เราต้องละลายสาร 10 กรัมในน้ำกี่กรัมเพื่อให้ได้สารละลาย 50%เรารู้จากคำแนะนำว่ามวลของสารคือ 10 g และเปอร์เซ็นต์ความเข้มข้นของสารละลายคือ 50%หมายความว่าสารละลาย 100 กรัมมีสาร 50 กรัม สามารถหามวลของสารละลายได้สองวิธี โปรดทราบว่ามวลของสารละลายไม่เท่ากับมวลของตัวทำละลาย ในการคำนวณมวลของตัวทำละลาย เราต้องลบมวลของสารออกจากมวลของสารละลาย วิธีที่ 1 จัดเรียงสูตรใหม่
ตัวอย่างที่ 2 เราต้องละลายสาร 10 กรัมในน้ำกี่กรัมเพื่อให้ได้สารละลาย 50%เรารู้จากคำแนะนำว่ามวลของสารคือ 10 g และเปอร์เซ็นต์ความเข้มข้นของสารละลายคือ 50%หมายความว่าสารละลาย 100 กรัมมีสาร 50 กรัม สามารถหามวลของสารละลายได้สองวิธี โปรดทราบว่ามวลของสารละลายไม่เท่ากับมวลของตัวทำละลาย ในการคำนวณมวลของตัวทำละลาย เราต้องลบมวลของสารออกจากมวลของสารละลาย วิธีที่ 1 จัดเรียงสูตรใหม่ 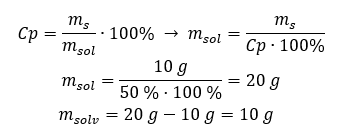 วิธีที่ 2 ใช้สัดส่วน โดยรู้ว่าสารละลาย 100 กรัมมีสาร 50 กรัม
วิธีที่ 2 ใช้สัดส่วน โดยรู้ว่าสารละลาย 100 กรัมมีสาร 50 กรัม 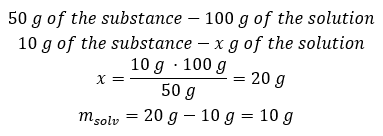 ไม่ว่าเราจะใช้วิธีใด คำตอบก็คือ เพื่อให้ได้สารละลาย 50%เราต้องละลายสาร 10 กรัมในน้ำ 10 กรัม
ไม่ว่าเราจะใช้วิธีใด คำตอบก็คือ เพื่อให้ได้สารละลาย 50%เราต้องละลายสาร 10 กรัมในน้ำ 10 กรัม
การเตรียมการแก้ปัญหา
องค์ประกอบสำคัญของงานในห้องปฏิบัติการคือความรู้ในการเตรียมสารละลายที่มีความเข้มข้นเฉพาะ เพื่อจุดประสงค์นั้นเราต้องทราบมวลของส่วนผสม มวลของสารที่คำนวณไว้ก่อนหน้านี้ควรละลายในปริมาตรที่วัดได้อย่างแม่นยำของตัวทำละลาย สามารถคำนวณปริมาตรที่ต้องการได้หากเราทราบมวลและความหนาแน่นของของเหลว ความหนาแน่นของสารละลายคือค่าทางกายภาพเฉพาะสำหรับของเหลวแต่ละชนิด ซึ่งกำหนดมวลของสารละลายต่อหน่วยปริมาตร ค่านั้นสัมพันธ์อย่างใกล้ชิดกับอุณหภูมิ ถ้าเรารู้ว่าสารละลายมีความหนาแน่น 2.03 g/ml เราก็รู้ด้วยว่าสารละลาย 1 มิลลิลิตรมีน้ำหนัก 2.03 g โดยปกติเราใช้หน่วยความหนาแน่นต่อไปนี้: g/ml = g/cm 3 , g/l = g/dm 3 แต่เราก็มีหน่วยอื่นๆ เช่น kg/m 3 เช่นกัน ความหนาแน่นของสารละลายคำนวณโดยใช้สูตรต่อไปนี้: d sol =m sol /v sol โดยที่ m sol คือมวลของสารละลาย และ V sol คือความหนาแน่น ถ้าเราทราบปริมาตรและความหนาแน่นของสารละลาย เราก็สามารถคำนวณมวลได้ ตัวอย่างที่ 3 สารละลาย 20 มล. ที่มีความหนาแน่น 1.201 กรัม/มล. มีมวลเท่าใด วิธีที่ 1 จัดเรียงสูตรใหม่ 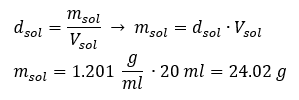 วิธีที่ 2 ใช้สัดส่วน โดยรู้ว่าสารละลาย 1.201 กรัม มีปริมาตร 1 มล.
วิธีที่ 2 ใช้สัดส่วน โดยรู้ว่าสารละลาย 1.201 กรัม มีปริมาตร 1 มล. 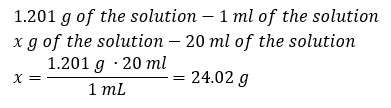 ทั้งสองวิธีแสดงให้เห็นว่าสารละลายที่มีความหนาแน่น 1.201 g/ml และปริมาตร 20 ml มีมวล 24.02 g หากเราทราบความหนาแน่น เราจะสามารถคำนวณได้มากขึ้นในบริบทของความเข้มข้นของเปอร์เซ็นต์ ตัวอย่างที่ 4 มีเกลือกี่กรัมในสารละลาย 15%10 มล. ถ้าความหนาแน่น 1.035 ก./มล. วิธีที่ 1 การจัดเรียงสูตรใหม่
ทั้งสองวิธีแสดงให้เห็นว่าสารละลายที่มีความหนาแน่น 1.201 g/ml และปริมาตร 20 ml มีมวล 24.02 g หากเราทราบความหนาแน่น เราจะสามารถคำนวณได้มากขึ้นในบริบทของความเข้มข้นของเปอร์เซ็นต์ ตัวอย่างที่ 4 มีเกลือกี่กรัมในสารละลาย 15%10 มล. ถ้าความหนาแน่น 1.035 ก./มล. วิธีที่ 1 การจัดเรียงสูตรใหม่ 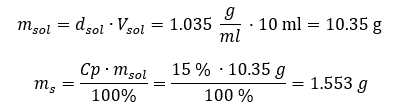 วิธีที่ 2 การใช้สัดส่วน
วิธีที่ 2 การใช้สัดส่วน 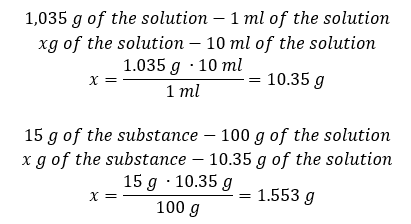 ทั้งสองวิธีแสดงให้เห็นว่าในการเตรียมสารละลาย 10 มล. ที่มี Cp = 15%และความหนาแน่น 1.035 กรัม/มล. เราต้องชั่งเกลือออก 1.553 กรัม ตัวอย่างที่ 5 ความเข้มข้นของสารละลายที่เกิดจากการละลายสาร 40 กรัมในเอทานอล 200 มล. ที่มีความหนาแน่น 0.78 กรัม/มล. เป็นเท่าใด ในการคำนวณเราสามารถใช้สูตรสำหรับความเข้มข้นร้อยละ มวลของสารละลายสามารถคำนวณได้โดยการบวกมวลของตัวถูกละลายและของตัวทำละลาย ไม่ทราบมวลของตัวทำละลาย แต่เราทราบความหนาแน่นและปริมาตร ดังนั้น ข้อมูลที่ขาดหายไปสามารถคำนวณได้โดยการจัดเรียงสูตรสำหรับความหนาแน่นใหม่
ทั้งสองวิธีแสดงให้เห็นว่าในการเตรียมสารละลาย 10 มล. ที่มี Cp = 15%และความหนาแน่น 1.035 กรัม/มล. เราต้องชั่งเกลือออก 1.553 กรัม ตัวอย่างที่ 5 ความเข้มข้นของสารละลายที่เกิดจากการละลายสาร 40 กรัมในเอทานอล 200 มล. ที่มีความหนาแน่น 0.78 กรัม/มล. เป็นเท่าใด ในการคำนวณเราสามารถใช้สูตรสำหรับความเข้มข้นร้อยละ มวลของสารละลายสามารถคำนวณได้โดยการบวกมวลของตัวถูกละลายและของตัวทำละลาย ไม่ทราบมวลของตัวทำละลาย แต่เราทราบความหนาแน่นและปริมาตร ดังนั้น ข้อมูลที่ขาดหายไปสามารถคำนวณได้โดยการจัดเรียงสูตรสำหรับความหนาแน่นใหม่