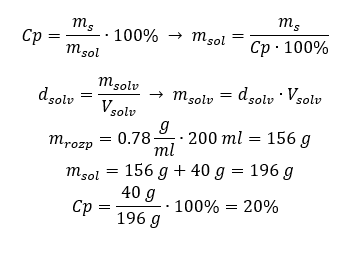Inom kemin använder vi ofta termer som "koncentrerad lösning", "utspädd lösning" eller "mättad lösning", men de ger oss bara en grundläggande översikt av om lösningen innehåller en stor eller liten mängd av ett visst ämne. Det finns dock några metoder som hjälper oss att exakt bestämma den kvantitativa sammansättningen av en given lösning. En av dem diskuteras i följande artikel.

Definition av procentkoncentration
Termen "koncentration" hänvisar till ett mått på mängden av ett givet ämne som finns i en viss lösning. Koncentration kan uttryckas i enheter utifrån de mått som vi använder, till exempel i mol, gram eller i procent. Procenthalt anger hur många viktdelar av det lösta ämnet som ingår i 100 viktdelar av lösningen. Med andra ord är det antalet gram av det lösta ämnet i 100 g av lösningen. Om vi till exempel köper mjölk märkt 3,2%betyder det att 100 g av mjölken innehåller 3,2 g fett. Procentkoncentration förkortas Cp.
Allmän formel för procentuell koncentration
För att härleda formeln för procentuell koncentration måste man komma ihåg att massan av en lösning (m sol ) innehåller inte bara massan av lösningsmedlet (m solv ) utan också massan av det lösta ämnet (m s ) : m sol = m solv + m s Om vi till exempel tar en 4 %lösning med en massa på 100 g, vet vi att Cp = 4 %, så ämnets massa är 4 g. Definitionen av procentkoncentration indikerar att om lösningens massa är 100 g, så är lösningsmedlets massa 96 g. Den procentuella koncentrationen kan beräknas med följande formel: Cp = (m s /m sol ) · 100%Som vi kan se av formeln, om vi känner till lösningens massa och ämnets massa, kan vi enkelt beräkna procentuell koncentration. Om vi till exempel vet att lösningen väger 450 g och det lösta ämnet väger 15 g, får vi följande genom att infoga dessa siffror i formeln: Cp = (15/450) · 100%= 3,3%
Beräkna massan av enskilda ingredienser i en lösning
Varje formel, inklusive den för procentuell koncentration, kan omarrangeras. Om vi vet lösningens massa och procentuella koncentration kan vi beräkna massan av det lösta ämnet. På samma sätt, om vi vet den procentuella koncentrationen och massan av ämnet, kan vi beräkna massan av lösningen. Förutom att ordna om formeln kan vi också använda lämpliga proportioner. Exempel 1. Hur många gram socker behöver vi för att förbereda 300 g av en 10%lösning? Vi vet från instruktionerna att lösningens massa är 300 g och att dess procentuella koncentration är 10 %. Massan av det lösta ämnet kan bestämmas med två metoder. Metod 1. Ordna om formeln 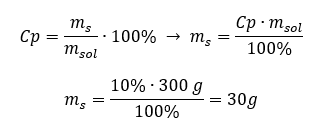 Metod 2. Använd proportionerna och veta att 10%-lösningen innehåller 10 g socker i 100 g av lösningen:
Metod 2. Använd proportionerna och veta att 10%-lösningen innehåller 10 g socker i 100 g av lösningen: 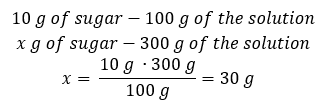 Båda metoderna kommer att leda oss till slutsatsen att beredningen av 300 g av en 10%lösning kommer att kräva 30 g socker.
Båda metoderna kommer att leda oss till slutsatsen att beredningen av 300 g av en 10%lösning kommer att kräva 30 g socker.  Exempel 2. I hur många gram vatten måste vi lösa 10 g av ett ämne för att få en 50%lösning? Vi vet från instruktionerna att ämnets massa är 10 g och att lösningens procentuella koncentration är 50 %. Detta innebär att 100 g av lösningen innehåller 50 g av ämnet. Lösningens massa kan bestämmas med två metoder. Observera att lösningens massa inte är lika med lösningsmedlets massa. För att beräkna lösningsmedlets massa måste vi subtrahera ämnets massa från lösningens massa. Metod 1. Ordna om formeln
Exempel 2. I hur många gram vatten måste vi lösa 10 g av ett ämne för att få en 50%lösning? Vi vet från instruktionerna att ämnets massa är 10 g och att lösningens procentuella koncentration är 50 %. Detta innebär att 100 g av lösningen innehåller 50 g av ämnet. Lösningens massa kan bestämmas med två metoder. Observera att lösningens massa inte är lika med lösningsmedlets massa. För att beräkna lösningsmedlets massa måste vi subtrahera ämnets massa från lösningens massa. Metod 1. Ordna om formeln 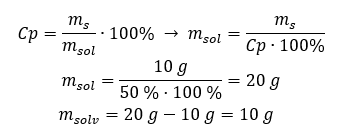 Metod 2. Använd proportionerna och veta att 100 g av lösningen innehåller 50 g av ämnet.
Metod 2. Använd proportionerna och veta att 100 g av lösningen innehåller 50 g av ämnet. 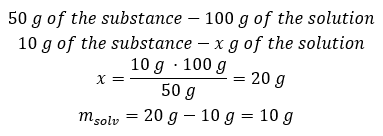 Oavsett vilken metod vi använder så blir svaret att för att få en 50 %lösning måste vi lösa 10 g av ämnet i 10 g vatten.
Oavsett vilken metod vi använder så blir svaret att för att få en 50 %lösning måste vi lösa 10 g av ämnet i 10 g vatten.
Förbereder lösningar
En viktig del av arbetet i ett laboratorium är kunskapen om hur man bereder lösningar med speciella koncentrationer. För detta ändamål måste vi känna till massan av dess ingredienser. En tidigare beräknad massa av ett ämne bör lösas i en noggrant uppmätt volym av ett lösningsmedel. Den erforderliga volymen kan beräknas om vi känner till vätskans massa och densitet. Lösningens densitet är ett fysiskt värde som är specifikt för varje vätska, som definierar lösningens massa per volymenhet. Det värdet är nära relaterat till temperaturen. Om vi vet att lösningens densitet är 2,03 g/ml, så vet vi också att 1 ml av lösningen väger 2,03 g. Vi använder vanligtvis följande densitetsenheter: g/ml = g/cm 3 , g/l = g/dm 3 , men vi finns också andra, såsom kg/m 3 . Lösningens densitet beräknas med följande formel: d sol =m sol /v sol , där m sol är lösningens massa och V sol är dess densitet. Om vi vet lösningens volym och densitet kan vi beräkna dess massa. Exempel 3. Vad är massan av 20 ml av en lösning med en densitet på 1,201 g/ml? Metod 1. Ordna om formeln 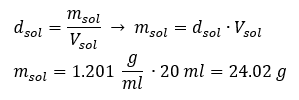 Metod 2. Använd proportionerna och veta att 1,201 g av lösningen har en volym på 1 ml
Metod 2. Använd proportionerna och veta att 1,201 g av lösningen har en volym på 1 ml 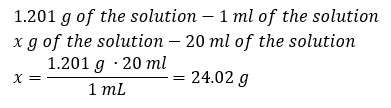 Båda metoderna har visat att lösningen med en densitet på 1,201 g/ml och en volym på 20 ml har en massa på 24,02 g. Om vi känner till densiteten kan vi utföra ännu fler beräkningar i samband med procentuell koncentration. Exempel 4. Hur många gram salt finns i 10 ml av en 15 %lösning om dess densitet är 1,035 g/ml? Metod 1. Ordna om formlerna
Båda metoderna har visat att lösningen med en densitet på 1,201 g/ml och en volym på 20 ml har en massa på 24,02 g. Om vi känner till densiteten kan vi utföra ännu fler beräkningar i samband med procentuell koncentration. Exempel 4. Hur många gram salt finns i 10 ml av en 15 %lösning om dess densitet är 1,035 g/ml? Metod 1. Ordna om formlerna 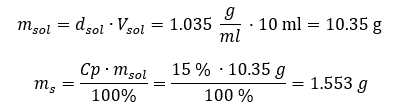 Metod 2. Använd proportionerna
Metod 2. Använd proportionerna 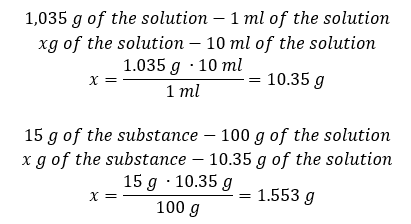 Båda metoderna har visat att för att framställa 10 ml av en lösning med Cp = 15 %och en densitet på 1,035 g/ml, måste vi väga upp 1,553 g salt. Exempel 5. Hur stor är den procentuella koncentrationen av en lösning som produceras genom att lösa 40 g av ett ämne i 200 ml etanol med en densitet på 0,78 g/ml? För att göra beräkningen kan vi använda formeln för procentuell koncentration. Lösningsmassan kan beräknas genom att lägga ihop massorna av det lösta ämnet och av lösningsmedlet. Lösningsmedlets massa är okänd, men vi känner till dess densitet och volym, så de saknade data kan beräknas genom att omarrangera formeln för densitet.
Båda metoderna har visat att för att framställa 10 ml av en lösning med Cp = 15 %och en densitet på 1,035 g/ml, måste vi väga upp 1,553 g salt. Exempel 5. Hur stor är den procentuella koncentrationen av en lösning som produceras genom att lösa 40 g av ett ämne i 200 ml etanol med en densitet på 0,78 g/ml? För att göra beräkningen kan vi använda formeln för procentuell koncentration. Lösningsmassan kan beräknas genom att lägga ihop massorna av det lösta ämnet och av lösningsmedlet. Lösningsmedlets massa är okänd, men vi känner till dess densitet och volym, så de saknade data kan beräknas genom att omarrangera formeln för densitet.