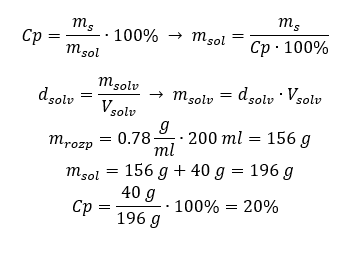У хімії ми часто використовуємо такі терміни, як «концентрований розчин», «розведений розчин» або «насичений розчин», але вони дають нам лише основне уявлення про те, чи містить розчин велику чи малу кількість певної речовини. Однак існує кілька методів, які допомагають точно визначити кількісний склад даного розчину. Про одну з них йдеться в наступній статті.

Визначення відсоткової концентрації
Термін «концентрація» означає міру кількості певної речовини, що міститься в конкретному розчині . Концентрація може бути виражена в одиницях на основі мір, які ми використовуємо, наприклад, у молях, грамах або у відсотках. Концентрація у відсотках показує, скільки масових частин розчиненої речовини входить до 100 масових частин розчину. Іншими словами, це кількість грамів розчиненої речовини в 100 г розчину. Наприклад, якщо ми купуємо молоко з маркуванням 3,2%, це означає, що в 100 г молока міститься 3,2 г жиру. Концентрація у відсотках скорочено позначається як Cp.
Загальна формула відсоткової концентрації
Щоб вивести формулу для відсоткової концентрації, слід пам’ятати, що маса розчину (m sol ) містить не тільки масу розчинника (m solv ) , але й масу розчиненої речовини (m s ) : m sol = m solv + m s Наприклад, якщо ми візьмемо 4 %розчин масою 100 г, то знаємо, що Cp = 4 %, тому маса речовини дорівнює 4 г. Визначення відсоткової концентрації показує, що якщо маса розчину 100 г, то маса розчинника 96 г. Відсоткову концентрацію можна розрахувати за такою формулою: Cp = (м ·с /м золю ) · 100%Як видно з формули, якщо ми знаємо масу розчину та масу речовини, ми можемо легко обчислити відсоткова концентрація. Наприклад, якщо ми знаємо, що розчин важить 450 г, а розчинена речовина — 15 г, то, підставивши ці числа у формулу, ми отримаємо наступне: Cp = (15/450) · 100%= 3,3%
Розрахунок маси окремих інгредієнтів у розчині
Кожну формулу, включно з формулою для відсоткової концентрації, можна змінити. Якщо ми знаємо масу та відсоткову концентрацію розчину, ми можемо обчислити масу розчиненої речовини. Подібним чином, якщо ми знаємо відсоткову концентрацію та масу речовини, ми можемо обчислити масу розчину. Окрім зміни формули, ми також можемо використовувати відповідні пропорції. Приклад 1. Скільки грамів цукру потрібно для приготування 300 г 10%розчину? З інструкції відомо, що маса розчину становить 300 г, а його процентна концентрація 10%. Масу розчиненої речовини можна визначити двома способами. Спосіб 1. Перестановка формули 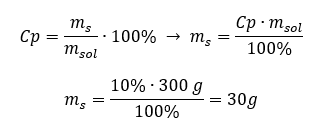 Спосіб 2. Використовуючи пропорції , знаючи, що 10%розчин містить 10 г цукру в 100 г розчину:
Спосіб 2. Використовуючи пропорції , знаючи, що 10%розчин містить 10 г цукру в 100 г розчину: 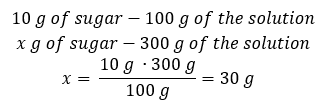 Обидва способи приведуть нас до висновку, що для приготування 300 г 10%розчину буде потрібно 30 г цукру.
Обидва способи приведуть нас до висновку, що для приготування 300 г 10%розчину буде потрібно 30 г цукру.  Приклад 2. У скільки грамів води треба розчинити 10 г речовини, щоб отримати 50%розчин? З інструкції відомо, що маса речовини становить 10 г, а концентрація розчину у відсотках становить 50%. Це означає, що в 100 г розчину міститься 50 г речовини. Масу розчину можна визначити двома способами. Зверніть увагу, що маса розчину не дорівнює масі розчинника. Щоб обчислити масу розчинника, потрібно від маси розчину відняти масу речовини. Спосіб 1. Перестановка формули
Приклад 2. У скільки грамів води треба розчинити 10 г речовини, щоб отримати 50%розчин? З інструкції відомо, що маса речовини становить 10 г, а концентрація розчину у відсотках становить 50%. Це означає, що в 100 г розчину міститься 50 г речовини. Масу розчину можна визначити двома способами. Зверніть увагу, що маса розчину не дорівнює масі розчинника. Щоб обчислити масу розчинника, потрібно від маси розчину відняти масу речовини. Спосіб 1. Перестановка формули 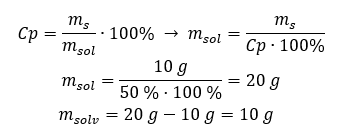 Спосіб 2. Використовуючи пропорції , знаючи, що в 100 г розчину міститься 50 г речовини.
Спосіб 2. Використовуючи пропорції , знаючи, що в 100 г розчину міститься 50 г речовини. 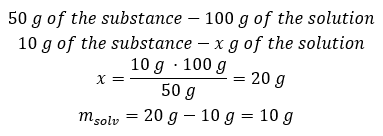 Незалежно від методу, який ми використаємо, відповідь буде такою, що для отримання 50%розчину необхідно розчинити 10 г речовини в 10 г води.
Незалежно від методу, який ми використаємо, відповідь буде такою, що для отримання 50%розчину необхідно розчинити 10 г речовини в 10 г води.
Приготування розчинів
Ключовим елементом роботи в лабораторії є знання того, як готувати розчини з певною концентрацією. Для цього ми повинні знати масу його інгредієнтів. Розраховану раніше масу речовини необхідно розчинити в точно відміряному об’ємі розчинника. Потрібний об’єм можна обчислити, якщо знати масу та густину рідини. Щільність розчину – це фізична величина, специфічна для кожної рідини, яка визначає масу розчину на одиницю об’єму. Ця величина тісно пов’язана з температурою. Якщо ми знаємо, що густина розчину 2,03 г/мл, то ми також знаємо, що 1 мл розчину важить 2,03 г. Зазвичай ми використовуємо такі одиниці густини: г/мл = г/см 3 , г/л = г/дм 3 , але є й інші, наприклад кг/м 3 . Щільність розчину обчислюється за такою формулою: d зол =m соль /v соль , де m соль — маса розчину, а V соль — його густина. Знаючи об’єм і густину розчину, можна обчислити його масу. Приклад 3. Яка маса 20 мл розчину густиною 1,201 г/мл? Спосіб 1. Перестановка формули 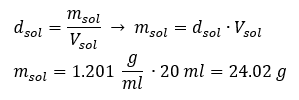 Спосіб 2. Використовуючи пропорції , знаючи, що 1,201 г розчину має об’єм 1 мл.
Спосіб 2. Використовуючи пропорції , знаючи, що 1,201 г розчину має об’єм 1 мл. 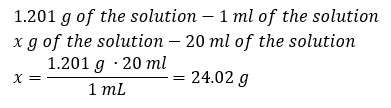 Обидва методи показали, що розчин густиною 1,201 г/мл об’ємом 20 мл має масу 24,02 г. Якщо ми знаємо щільність, ми можемо виконати ще більше обчислень у контексті концентрації у відсотках. Приклад 4. Скільки грамів солі міститься в 10 мл 15%розчину, якщо його густина 1,035 г/мл? Спосіб 1. Перестановка формул
Обидва методи показали, що розчин густиною 1,201 г/мл об’ємом 20 мл має масу 24,02 г. Якщо ми знаємо щільність, ми можемо виконати ще більше обчислень у контексті концентрації у відсотках. Приклад 4. Скільки грамів солі міститься в 10 мл 15%розчину, якщо його густина 1,035 г/мл? Спосіб 1. Перестановка формул 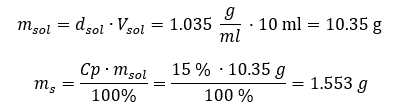 Спосіб 2. Використання пропорцій
Спосіб 2. Використання пропорцій 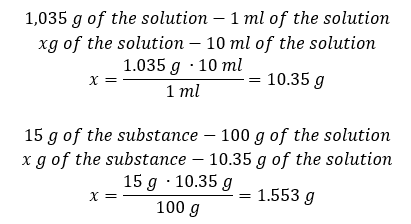 Обидва методи показали, що для приготування 10 мл розчину з Cp = 15%і густиною 1,035 г/мл необхідно зважити 1,553 г солі. Приклад 5. Яка концентрація розчину у відсотках утворюється при розчиненні 40 г речовини в 200 мл етанолу густиною 0,78 г/мл? Для розрахунку можна скористатися формулою відсоткової концентрації. Масу розчину можна обчислити, склавши маси розчиненої речовини та маси розчинника. Маса розчинника невідома, але ми знаємо його густину та об’єм, тому відсутні дані можна обчислити, переставивши формулу для густини.
Обидва методи показали, що для приготування 10 мл розчину з Cp = 15%і густиною 1,035 г/мл необхідно зважити 1,553 г солі. Приклад 5. Яка концентрація розчину у відсотках утворюється при розчиненні 40 г речовини в 200 мл етанолу густиною 0,78 г/мл? Для розрахунку можна скористатися формулою відсоткової концентрації. Масу розчину можна обчислити, склавши маси розчиненої речовини та маси розчинника. Маса розчинника невідома, але ми знаємо його густину та об’єм, тому відсутні дані можна обчислити, переставивши формулу для густини.