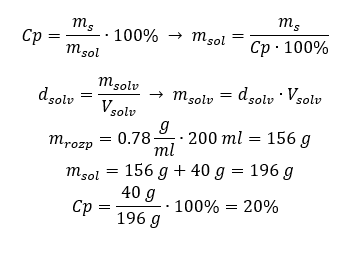In chimica, usiamo spesso termini come "soluzione concentrata", "soluzione diluita" o "soluzione satura", ma ci danno solo un quadro di base del fatto che la soluzione contenga una quantità grande o piccola di una particolare sostanza. Tuttavia, ci sono alcuni metodi che ci aiutano a determinare con precisione la composizione quantitativa di una data soluzione. Uno di questi è discusso nel seguente articolo.

Definizione di concentrazione percentuale
Il termine “concentrazione” si riferisce a una misura della quantità di una data sostanza contenuta in una particolare soluzione . La concentrazione può essere espressa in unità in base alle misure che utilizziamo, ad esempio in moli, grammi o in percentuale. La concentrazione percentuale indica quante parti in massa del soluto sono incluse in 100 parti in massa della soluzione. In altre parole, è il numero di grammi di soluto in 100 g di soluzione. Ad esempio, se acquistiamo latte etichettato 3,2%, significa che 100 g di latte contengono 3,2 g di grassi. La concentrazione percentuale è abbreviata come Cp.
Formula generale della concentrazione percentuale
Per derivare la formula della concentrazione percentuale, bisogna ricordare che la massa di una soluzione (m sol ) contiene non solo la massa del solvente (m solv ) ma anche la massa del soluto (m s ) : m sol = m solv + m s Ad esempio, se prendiamo una soluzione al 4%con una massa di 100 g, sappiamo che Cp = 4%, quindi la massa della sostanza è 4 g. La definizione di concentrazione percentuale indica che se la massa della soluzione è 100 g, la massa del solvente è 96 g. La concentrazione percentuale può essere calcolata con la seguente formula: Cp = (m s /m sol ) · 100%Come si vede dalla formula, se conosciamo la massa della soluzione e la massa della sostanza, possiamo facilmente calcolare la concentrazione percentuale. Ad esempio, se sappiamo che la soluzione pesa 450 g e il soluto pesa 15 g, allora inserendo questi numeri nella formula otteniamo quanto segue: Cp = (15/450) · 100%= 3,3%
Calcolo della massa dei singoli ingredienti in una soluzione
Ogni formula, inclusa quella per la concentrazione percentuale, può essere riorganizzata. Se conosciamo la massa e la concentrazione percentuale della soluzione, possiamo calcolare la massa del soluto. Allo stesso modo, se conosciamo la concentrazione percentuale e la massa della sostanza, possiamo calcolare la massa della soluzione. Oltre a riorganizzare la formula, possiamo anche usare proporzioni appropriate. Esempio 1. Di quanti grammi di zucchero abbiamo bisogno per preparare 300 g di una soluzione al 10%? Sappiamo dalle istruzioni che la massa della soluzione è di 300 g e che la sua concentrazione percentuale è del 10%. La massa del soluto può essere determinata con due metodi. Metodo 1. Riorganizzare la formula 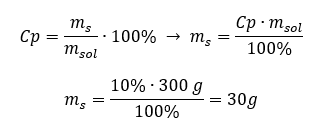 Metodo 2. Utilizzando le proporzioni , sapendo che la soluzione al 10%contiene 10 g di zucchero in 100 g di soluzione:
Metodo 2. Utilizzando le proporzioni , sapendo che la soluzione al 10%contiene 10 g di zucchero in 100 g di soluzione: 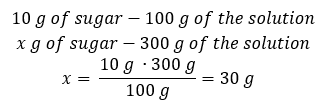 Entrambi i metodi ci porteranno alla conclusione che la preparazione di 300 g di una soluzione al 10%richiederà 30 g di zucchero.
Entrambi i metodi ci porteranno alla conclusione che la preparazione di 300 g di una soluzione al 10%richiederà 30 g di zucchero.  Esempio 2. In quanti grammi di acqua dobbiamo sciogliere 10 g di una sostanza per ottenere una soluzione al 50%? Sappiamo dalle istruzioni che la massa della sostanza è di 10 g e che la concentrazione percentuale della soluzione è del 50%. Ciò implica che 100 g della soluzione contengono 50 g della sostanza. La massa della soluzione può essere determinata con due metodi. Si noti che la massa della soluzione non è uguale alla massa del solvente. Per calcolare la massa del solvente, dobbiamo sottrarre la massa della sostanza dalla massa della soluzione. Metodo 1. Riorganizzare la formula
Esempio 2. In quanti grammi di acqua dobbiamo sciogliere 10 g di una sostanza per ottenere una soluzione al 50%? Sappiamo dalle istruzioni che la massa della sostanza è di 10 g e che la concentrazione percentuale della soluzione è del 50%. Ciò implica che 100 g della soluzione contengono 50 g della sostanza. La massa della soluzione può essere determinata con due metodi. Si noti che la massa della soluzione non è uguale alla massa del solvente. Per calcolare la massa del solvente, dobbiamo sottrarre la massa della sostanza dalla massa della soluzione. Metodo 1. Riorganizzare la formula 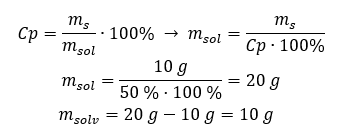 Metodo 2. Usando le proporzioni , sapendo che 100 g della soluzione contengono 50 g della sostanza.
Metodo 2. Usando le proporzioni , sapendo che 100 g della soluzione contengono 50 g della sostanza. 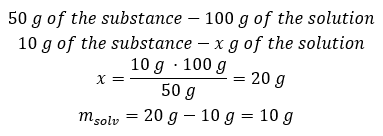 Indipendentemente dal metodo che utilizziamo, la risposta sarà che per ottenere una soluzione al 50 %dobbiamo sciogliere 10 g della sostanza in 10 g di acqua.
Indipendentemente dal metodo che utilizziamo, la risposta sarà che per ottenere una soluzione al 50 %dobbiamo sciogliere 10 g della sostanza in 10 g di acqua.
Preparare soluzioni
Un elemento chiave del lavoro in un laboratorio è la conoscenza di come preparare soluzioni con concentrazioni particolari. A tal fine, dobbiamo conoscere la massa dei suoi ingredienti. Una massa di una sostanza calcolata in precedenza dovrebbe essere sciolta in un volume accuratamente misurato di un solvente. Il volume richiesto può essere calcolato se conosciamo la massa e la densità del liquido. La densità della soluzione è un valore fisico specifico per ogni liquido, che definisce la massa della soluzione per unità di volume. Tale valore è strettamente correlato alla temperatura. Se sappiamo che la densità della soluzione è 2,03 g/ml, allora sappiamo anche che 1 ml della soluzione pesa 2,03 g. Usiamo solitamente le seguenti unità di densità: g/ml = g/cm 3 , g/l = g/dm 3 , ma ne esistono anche altre, come kg/m 3 . La densità della soluzione è calcolata con la seguente formula: d sol =m sol /v sol , dove m sol è la massa della soluzione e V sol è la sua densità. Se conosciamo il volume e la densità della soluzione, possiamo calcolarne la massa. Esempio 3. Qual è la massa di 20 ml di una soluzione con una densità di 1,201 g/ml? Metodo 1. Riorganizzare la formula 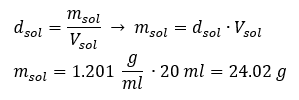 Metodo 2. Utilizzando le proporzioni , sapendo che 1,201 g della soluzione ha un volume di 1 ml
Metodo 2. Utilizzando le proporzioni , sapendo che 1,201 g della soluzione ha un volume di 1 ml 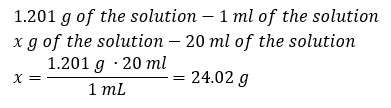 Entrambi i metodi hanno dimostrato che la soluzione con una densità di 1,201 g/ml e un volume di 20 ml ha una massa di 24,02 g. Se conosciamo la densità, possiamo eseguire ancora più calcoli nel contesto della concentrazione percentuale. Esempio 4. Quanti grammi di sale sono contenuti in 10 ml di una soluzione al 15 %se la sua densità è 1,035 g/ml? Metodo 1. Riordinare le formule
Entrambi i metodi hanno dimostrato che la soluzione con una densità di 1,201 g/ml e un volume di 20 ml ha una massa di 24,02 g. Se conosciamo la densità, possiamo eseguire ancora più calcoli nel contesto della concentrazione percentuale. Esempio 4. Quanti grammi di sale sono contenuti in 10 ml di una soluzione al 15 %se la sua densità è 1,035 g/ml? Metodo 1. Riordinare le formule 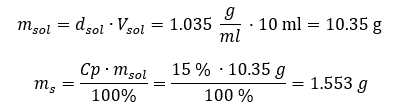 Metodo 2. Usando le proporzioni
Metodo 2. Usando le proporzioni 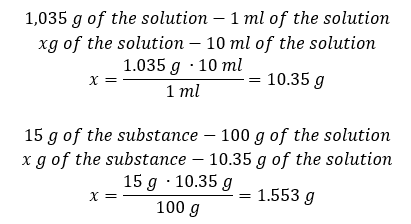 Entrambi i metodi hanno dimostrato che per preparare 10 ml di una soluzione con Cp = 15%e densità di 1,035 g/ml, dobbiamo pesare 1,553 g di sale. Esempio 5. Qual è la concentrazione percentuale di una soluzione prodotta sciogliendo 40 g di una sostanza in 200 ml di etanolo con una densità di 0,78 g/ml? Per fare il calcolo, possiamo usare la formula per la concentrazione percentuale. La massa della soluzione può essere calcolata sommando le masse del soluto e del solvente. La massa del solvente è sconosciuta, ma ne conosciamo la densità e il volume, quindi i dati mancanti possono essere calcolati riorganizzando la formula per la densità.
Entrambi i metodi hanno dimostrato che per preparare 10 ml di una soluzione con Cp = 15%e densità di 1,035 g/ml, dobbiamo pesare 1,553 g di sale. Esempio 5. Qual è la concentrazione percentuale di una soluzione prodotta sciogliendo 40 g di una sostanza in 200 ml di etanolo con una densità di 0,78 g/ml? Per fare il calcolo, possiamo usare la formula per la concentrazione percentuale. La massa della soluzione può essere calcolata sommando le masse del soluto e del solvente. La massa del solvente è sconosciuta, ma ne conosciamo la densità e il volume, quindi i dati mancanti possono essere calcolati riorganizzando la formula per la densità.