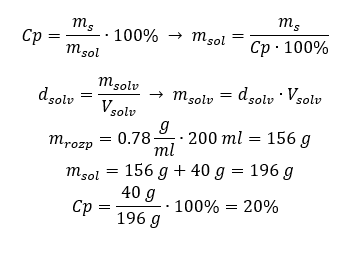En chimie, nous utilisons souvent des termes tels que « solution concentrée », « solution diluée » ou « solution saturée », mais ils ne nous donnent qu'un aperçu de base indiquant si la solution contient une grande ou une petite quantité d'une substance particulière. Cependant, il existe quelques méthodes qui nous aident à déterminer avec précision la composition quantitative d'une solution donnée. L'un d'eux est abordé dans l'article suivant.

Définition du pourcentage de concentration
Le terme « concentration » fait référence à une mesure de la quantité d’une substance donnée contenue dans une solution particulière . La concentration peut être exprimée en unités basées sur les mesures que nous utilisons, par exemple en moles, en grammes ou en pourcentage. La concentration en pourcentage indique combien de parties en masse du soluté sont incluses dans 100 parties en masse de la solution. En d’autres termes, c’est le nombre de grammes de soluté dans 100 g de solution. Par exemple, si nous achetons du lait étiqueté 3,2 %, cela signifie que 100 g de lait contiennent 3,2 g de matière grasse. La concentration en pourcentage est abrégée en Cp.
Formule générale de pourcentage de concentration
Pour dériver la formule de la concentration en pourcentage, il faut se rappeler que la masse d’une solution (m sol ) contient non seulement la masse du solvant (m solv ) mais aussi la masse du soluté (m s ) : m sol = m solv + m s Par exemple, si nous prenons une solution à 4 %avec une masse de 100 g, nous savons que Cp = 4 %, donc la masse de la substance est de 4 g. La définition de la concentration en pourcentage indique que si la masse de la solution est de 100 g, alors la masse du solvant est de 96 g. La concentration en pourcentage peut être calculée avec la formule suivante : Cp = (m s /m sol ) · 100 %Comme nous pouvons le voir dans la formule, si nous connaissons la masse de la solution et la masse de la substance, nous pouvons facilement calculer la concentration en pourcentage. Par exemple, si on sait que la solution pèse 450 g et que le soluté pèse 15 g, alors en insérant ces nombres dans la formule, on obtient : Cp = (15/450) · 100 %= 3,3 %
Calcul de la masse des ingrédients individuels dans une solution
Chaque formule, y compris celle du pourcentage de concentration, peut être réorganisée. Si nous connaissons la masse et la concentration en pourcentage de la solution, nous pouvons calculer la masse du soluté. De même, si nous connaissons la concentration en pourcentage et la masse de la substance, nous pouvons calculer la masse de la solution. En plus de réorganiser la formule, nous pouvons également utiliser des proportions appropriées. Exemple 1. De combien de grammes de sucre avons-nous besoin pour préparer 300 g d’une solution à 10 %? Nous savons d’après les instructions que la masse de la solution est de 300 g et que sa concentration en pourcentage est de 10 %. La masse du soluté peut être déterminée par deux méthodes. Méthode 1. Réorganiser la formule 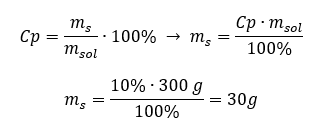 Méthode 2. En utilisant les proportions , sachant que la solution à 10 %contient 10 g de sucre dans 100 g de solution :
Méthode 2. En utilisant les proportions , sachant que la solution à 10 %contient 10 g de sucre dans 100 g de solution : 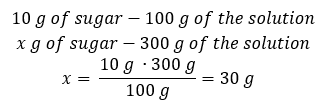 Les deux méthodes nous conduiront à la conclusion que la préparation de 300 g d’une solution à 10%nécessitera 30 g de sucre.
Les deux méthodes nous conduiront à la conclusion que la préparation de 300 g d’une solution à 10%nécessitera 30 g de sucre.  Exemple 2. Dans combien de grammes d’eau doit-on dissoudre 10 g d’une substance pour obtenir une solution à 50 %? Nous savons d’après les instructions que la masse de la substance est de 10 g et que la concentration en pourcentage de la solution est de 50%. Cela implique que 100 g de la solution contiennent 50 g de la substance. La masse de la solution peut être déterminée par deux méthodes. Veuillez noter que la masse de la solution n’est pas égale à la masse du solvant. Pour calculer la masse du solvant, nous devons soustraire la masse de la substance de la masse de la solution. Méthode 1. Réorganiser la formule
Exemple 2. Dans combien de grammes d’eau doit-on dissoudre 10 g d’une substance pour obtenir une solution à 50 %? Nous savons d’après les instructions que la masse de la substance est de 10 g et que la concentration en pourcentage de la solution est de 50%. Cela implique que 100 g de la solution contiennent 50 g de la substance. La masse de la solution peut être déterminée par deux méthodes. Veuillez noter que la masse de la solution n’est pas égale à la masse du solvant. Pour calculer la masse du solvant, nous devons soustraire la masse de la substance de la masse de la solution. Méthode 1. Réorganiser la formule 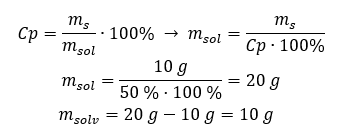 Méthode 2. En utilisant les proportions , sachant que 100 g de la solution contiennent 50 g de la substance.
Méthode 2. En utilisant les proportions , sachant que 100 g de la solution contiennent 50 g de la substance. 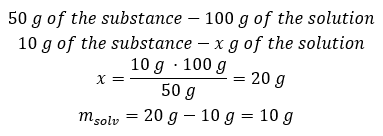 Quelle que soit la méthode que nous utilisons, la réponse sera que pour obtenir une solution à 50%, nous devons dissoudre 10 g de la substance dans 10 g d’eau.
Quelle que soit la méthode que nous utilisons, la réponse sera que pour obtenir une solution à 50%, nous devons dissoudre 10 g de la substance dans 10 g d’eau.
Préparer des solutions
Un élément clé du travail dans un laboratoire est la connaissance de la façon de préparer des solutions avec des concentrations particulières. Pour cela, nous devons connaître la masse de ses ingrédients. Une masse préalablement calculée d’une substance doit être dissoute dans un volume mesuré avec précision d’un solvant. Le volume requis peut être calculé si nous connaissons la masse et la densité du liquide. La densité de la solution est une valeur physique propre à chaque liquide, qui définit la masse de la solution par unité de volume. Cette valeur est étroitement liée à la température. Si nous savons que la densité de la solution est de 2,03 g/ml, nous savons également que 1 ml de la solution pèse 2,03 g. On utilise habituellement les unités de masse volumique suivantes : g/ml = g/cm 3 , g/l = g/dm 3 , mais il en existe aussi d’autres, comme le kg/m 3 . La densité de la solution est calculée avec la formule suivante : d sol =m sol /v sol , où m sol est la masse de la solution et V sol sa densité. Si nous connaissons le volume et la densité de la solution, nous pouvons calculer sa masse. Exemple 3. Quelle est la masse de 20 ml d’une solution de densité 1,201 g/ml ? Méthode 1. Réorganiser la formule 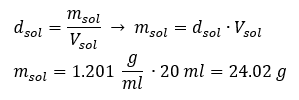 Méthode 2. En utilisant les proportions , sachant que 1,201 g de la solution a un volume de 1 ml
Méthode 2. En utilisant les proportions , sachant que 1,201 g de la solution a un volume de 1 ml 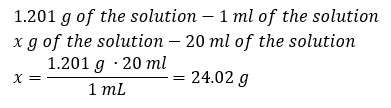 Les deux méthodes ont démontré que la solution avec une densité de 1,201 g/ml et un volume de 20 ml a une masse de 24,02 g. Si nous connaissons la densité, nous pouvons effectuer encore plus de calculs dans le contexte de la concentration en pourcentage. Exemple 4. Combien de grammes de sel sont contenus dans 10 ml d’une solution à 15 %si sa densité est de 1,035 g/ml ? Méthode 1. Réorganiser les formules
Les deux méthodes ont démontré que la solution avec une densité de 1,201 g/ml et un volume de 20 ml a une masse de 24,02 g. Si nous connaissons la densité, nous pouvons effectuer encore plus de calculs dans le contexte de la concentration en pourcentage. Exemple 4. Combien de grammes de sel sont contenus dans 10 ml d’une solution à 15 %si sa densité est de 1,035 g/ml ? Méthode 1. Réorganiser les formules 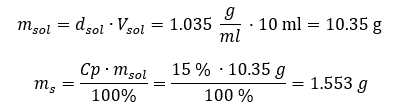 Méthode 2. Utilisation des proportions
Méthode 2. Utilisation des proportions 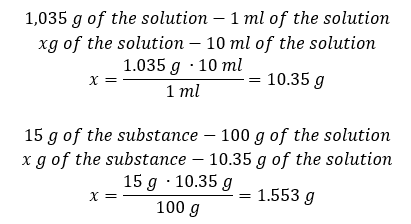 Les deux méthodes ont démontré que pour préparer 10 ml d’une solution avec Cp = 15 %et une densité de 1,035 g/ml, il faut peser 1,553 g de sel. Exemple 5. Quel est le pourcentage de concentration d’une solution obtenue en dissolvant 40 g d’une substance dans 200 ml d’éthanol d’une densité de 0,78 g/ml ? Pour faire le calcul, nous pouvons utiliser la formule de pourcentage de concentration. La masse de la solution peut être calculée en additionnant les masses du soluté et du solvant. La masse du solvant est inconnue, mais nous connaissons sa densité et son volume, de sorte que les données manquantes peuvent être calculées en réorganisant la formule de densité.
Les deux méthodes ont démontré que pour préparer 10 ml d’une solution avec Cp = 15 %et une densité de 1,035 g/ml, il faut peser 1,553 g de sel. Exemple 5. Quel est le pourcentage de concentration d’une solution obtenue en dissolvant 40 g d’une substance dans 200 ml d’éthanol d’une densité de 0,78 g/ml ? Pour faire le calcul, nous pouvons utiliser la formule de pourcentage de concentration. La masse de la solution peut être calculée en additionnant les masses du soluté et du solvant. La masse du solvant est inconnue, mais nous connaissons sa densité et son volume, de sorte que les données manquantes peuvent être calculées en réorganisant la formule de densité.