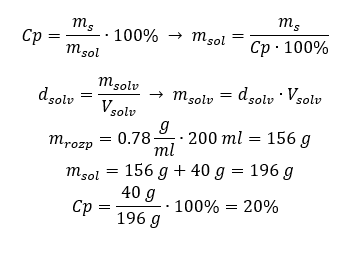Kimyada genellikle "konsantre çözelti", "seyreltilmiş çözelti" veya "doymuş çözelti" gibi terimler kullanırız, ancak bunlar bize yalnızca çözeltinin belirli bir maddeden büyük veya az miktarda içerip içermediği konusunda temel bir taslak verir. Bununla birlikte, belirli bir çözümün nicel bileşimini doğru bir şekilde belirlememize yardımcı olan birkaç yöntem vardır. Bunlardan biri aşağıdaki makalede tartışılmaktadır.

Yüzde konsantrasyonunun tanımı
"Konsantrasyon" terimi, belirli bir çözeltide bulunan belirli bir maddenin miktarının bir ölçüsünü ifade eder . Konsantrasyon, kullandığımız ölçümlere dayalı olarak, örneğin mol, gram veya yüzde cinsinden ifade edilebilir. Yüzde konsantrasyonu, çözeltinin kütlece 100 kısmına kaç tane çözünen maddenin dahil edildiğini gösterir. Başka bir deyişle, 100 g çözeltide çözünen maddenin gram sayısıdır. Örneğin %3,2 etiketli bir süt alırsak, 100 gr süt 3,2 gr yağ içerir demektir. Yüzde konsantrasyonu Cp olarak kısaltılır.
Yüzde konsantrasyonunun genel formülü
Yüzde konsantrasyon formülünü türetmek için, bir çözeltinin kütlesinin (m sol ) yalnızca çözücünün kütlesini (m solv ) değil aynı zamanda çözünen maddenin kütlesini de (m s ) içerdiği unutulmamalıdır: m sol = m solv + m s Örneğin, kütlesi 100 g olan %4’lük bir çözelti alırsak, Cp = %4 olduğunu biliyoruz, dolayısıyla maddenin kütlesi 4 g’dır. Yüzde konsantrasyonun tanımı, çözeltinin kütlesi 100 g ise çözücünün kütlesinin 96 g olduğunu gösterir. Yüzde derişim aşağıdaki formülle hesaplanabilir: Cp = (m s /m sol ) · %100 Formülden de anlayacağımız gibi çözeltinin kütlesini ve maddenin kütlesini biliyorsak, kolayca hesaplayabiliriz. yüzde konsantrasyonu. Örneğin, çözeltinin 450 g ve çözünen maddenin 15 g olduğunu biliyorsak, bu sayıları formüle ekleyerek aşağıdakini elde ederiz: Cp = (15/450) · %100 = %3,3
Bir çözeltideki tek tek bileşenlerin kütlesinin hesaplanması
Yüzde konsantrasyonu da dahil olmak üzere her formül yeniden düzenlenebilir. Çözeltinin kütlesini ve yüzde konsantrasyonunu bilirsek, çözünenin kütlesini hesaplayabiliriz. Benzer şekilde, maddenin yüzde derişimini ve kütlesini bilirsek, çözeltinin kütlesini de hesaplayabiliriz. Formülü yeniden düzenlemenin yanı sıra uygun orantıları da kullanabiliriz. Örnek 1. 300 g %10’luk çözelti hazırlamak için kaç gram şekere ihtiyacımız var? Talimatlardan, çözeltinin kütlesinin 300 g olduğunu ve yüzde konsantrasyonunun %10 olduğunu biliyoruz. Çözünen maddenin kütlesi iki yöntemle belirlenebilir. Yöntem 1. Formülü yeniden düzenleme 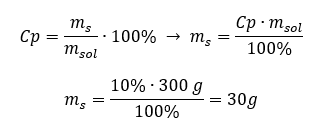 Yöntem 2. Oranları kullanarak , %10’luk çözeltinin 100 g çözeltide 10 g şeker içerdiğini bilerek:
Yöntem 2. Oranları kullanarak , %10’luk çözeltinin 100 g çözeltide 10 g şeker içerdiğini bilerek: 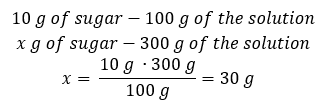 Her iki yöntem de bizi 300 g %10’luk bir çözeltinin hazırlanmasının 30 g şeker gerektireceği sonucuna götürecektir.
Her iki yöntem de bizi 300 g %10’luk bir çözeltinin hazırlanmasının 30 g şeker gerektireceği sonucuna götürecektir.  Örnek 2. %50’lik bir çözelti elde etmek için 10 g maddeyi kaç gram suda eritmemiz gerekir? Maddenin kütlesinin 10 g olduğunu ve çözeltinin yüzde derişiminin %50 olduğunu talimatlardan biliyoruz. Bu, 100 g çözeltinin 50 g madde içerdiği anlamına gelir. Çözeltinin kütlesi iki yöntemle belirlenebilir. Lütfen çözeltinin kütlesinin çözücünün kütlesine eşit olmadığına dikkat edin. Çözücünün kütlesini hesaplamak için, maddenin kütlesini çözeltinin kütlesinden çıkarmalıyız. Yöntem 1. Formülü yeniden düzenleme
Örnek 2. %50’lik bir çözelti elde etmek için 10 g maddeyi kaç gram suda eritmemiz gerekir? Maddenin kütlesinin 10 g olduğunu ve çözeltinin yüzde derişiminin %50 olduğunu talimatlardan biliyoruz. Bu, 100 g çözeltinin 50 g madde içerdiği anlamına gelir. Çözeltinin kütlesi iki yöntemle belirlenebilir. Lütfen çözeltinin kütlesinin çözücünün kütlesine eşit olmadığına dikkat edin. Çözücünün kütlesini hesaplamak için, maddenin kütlesini çözeltinin kütlesinden çıkarmalıyız. Yöntem 1. Formülü yeniden düzenleme 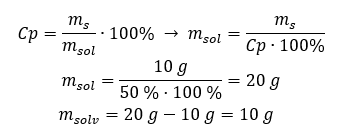 Yöntem 2. Oranları kullanma , 100 g çözeltinin 50 g madde içerdiğini bilerek.
Yöntem 2. Oranları kullanma , 100 g çözeltinin 50 g madde içerdiğini bilerek. 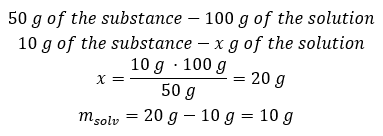 Hangi yöntemi kullanırsak kullanalım, cevap %50’lik bir çözelti elde etmek için 10 gr maddeyi 10 gr suda eritmemiz gerektiği olacaktır.
Hangi yöntemi kullanırsak kullanalım, cevap %50’lik bir çözelti elde etmek için 10 gr maddeyi 10 gr suda eritmemiz gerektiği olacaktır.
Çözüm hazırlama
Bir laboratuvarda çalışmanın kilit unsurlarından biri, belirli konsantrasyonlarda solüsyonların nasıl hazırlanacağını bilmektir. Bu amaçla, bileşenlerinin kütlesini bilmeliyiz. Bir maddenin önceden hesaplanmış kütlesi, doğru olarak ölçülmüş bir çözücü hacmi içinde çözülmelidir. Sıvının kütlesini ve yoğunluğunu bilirsek gerekli hacim hesaplanabilir. Çözelti yoğunluğu, çözeltinin hacim birimi başına kütlesini tanımlayan, her bir sıvıya özgü fiziksel bir değerdir. Bu değer sıcaklıkla yakından ilgilidir. Çözelti yoğunluğunun 2,03 g/ml olduğunu biliyorsak, 1 ml çözeltinin 2,03 g olduğunu da biliyoruz. Genellikle aşağıdaki yoğunluk birimlerini kullanırız: g/ml = g/ cm3 , g/l = g/ dm3 , ancak kg/ m3 gibi başka yoğunluk birimleri de vardır. Çözelti yoğunluğu aşağıdaki formülle hesaplanır: d sol = m sol / v sol , burada m sol, çözeltinin kütlesidir ve V sol, yoğunluğudur. Çözeltinin hacmini ve yoğunluğunu bilirsek kütlesini hesaplayabiliriz. Örnek 3. Yoğunluğu 1.201 g/ml olan 20 ml çözeltinin kütlesi nedir? Yöntem 1. Formülü yeniden düzenleme 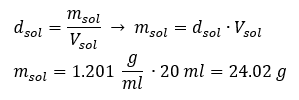 Yöntem 2. 1.201 g çözeltinin 1 ml hacme sahip olduğunu bilerek orantıları kullanma
Yöntem 2. 1.201 g çözeltinin 1 ml hacme sahip olduğunu bilerek orantıları kullanma 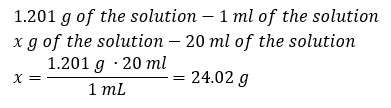 Her iki yöntem de yoğunluğu 1.201 g/ml ve hacmi 20 ml olan çözeltinin kütlesinin 24.02 g olduğunu göstermiştir. Yoğunluğu bilirsek, yüzde konsantrasyon bağlamında daha da fazla hesaplama yapabiliriz. Örnek 4. Yoğunluğu 1.035 g/ml ise, 10 ml %15’lik bir çözeltide kaç gram tuz bulunur? Yöntem 1. Formülleri yeniden düzenleme
Her iki yöntem de yoğunluğu 1.201 g/ml ve hacmi 20 ml olan çözeltinin kütlesinin 24.02 g olduğunu göstermiştir. Yoğunluğu bilirsek, yüzde konsantrasyon bağlamında daha da fazla hesaplama yapabiliriz. Örnek 4. Yoğunluğu 1.035 g/ml ise, 10 ml %15’lik bir çözeltide kaç gram tuz bulunur? Yöntem 1. Formülleri yeniden düzenleme 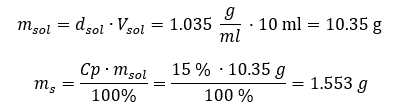 Yöntem 2. Oranları kullanma
Yöntem 2. Oranları kullanma 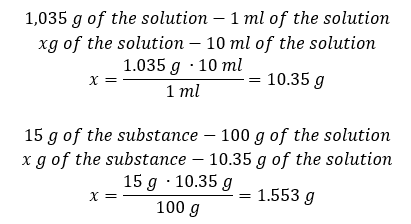 Her iki yöntem de Cp = %15 ve 1.035 g/ml yoğunluğa sahip 10 ml’lik bir çözelti hazırlamak için 1.553 g tuz tartmamız gerektiğini göstermiştir. Örnek 5. 40 g maddenin 0,78 g/ml yoğunluğa sahip 200 ml etanol içinde çözülmesiyle elde edilen bir çözeltinin derişim yüzdesi nedir? Hesaplamayı yapmak için yüzde konsantrasyon formülünü kullanabiliriz. Çözelti kütlesi, çözünen maddenin ve çözücünün kütlelerinin toplanmasıyla hesaplanabilir. Çözücünün kütlesi bilinmiyor, ancak yoğunluğunu ve hacmini biliyoruz, bu nedenle kayıp veriler, yoğunluk formülünü yeniden düzenleyerek hesaplanabilir.
Her iki yöntem de Cp = %15 ve 1.035 g/ml yoğunluğa sahip 10 ml’lik bir çözelti hazırlamak için 1.553 g tuz tartmamız gerektiğini göstermiştir. Örnek 5. 40 g maddenin 0,78 g/ml yoğunluğa sahip 200 ml etanol içinde çözülmesiyle elde edilen bir çözeltinin derişim yüzdesi nedir? Hesaplamayı yapmak için yüzde konsantrasyon formülünü kullanabiliriz. Çözelti kütlesi, çözünen maddenin ve çözücünün kütlelerinin toplanmasıyla hesaplanabilir. Çözücünün kütlesi bilinmiyor, ancak yoğunluğunu ve hacmini biliyoruz, bu nedenle kayıp veriler, yoğunluk formülünü yeniden düzenleyerek hesaplanabilir.