Розчини є незамінним елементом у повсякденній роботі хіміка. Вони відіграють особливо важливу роль в об'ємному хімічному аналізі, який досі успішно використовується для рутинних визначень. Важливу роль відіграють стандартні розчини, тобто з точно відомою концентрацією.

Значення стандартних розчинів у хімії
Стандартні розчини – це розчини, концентрація яких точно відома. Вони мають велике значення в об’ємному (титраційному) аналізі, який є одним з розділів кількісного аналізу . Порівняно з гравіметричними визначеннями, де для осадження має бути використана точна кількість реагенту, під час визначення титрування додається еквівалентна кількість розчину реагенту для титрування. Це передбачає використання стандартних розчинів для розрахунку вмісту аналіту в зразку на основі рівняння реакції. Методи титрування все ще використовуються в повсякденній лабораторній практиці, наприклад, при визначенні вмісту хлорид-іонів за методом Вінклера (в цьому випадку реактивом стандартного розчину, тобто реактивом для титрування, є розчин срібла (I) нітрату (V), AgNO 3 ). Необхідно точно знати концентрацію стандартних розчинів. Найчастіше його точність дають до десятитисячного розряду (четвертий знак після коми). Концентрація зазвичай виражається в молях даної речовини, розчиненої в одному літрі розчину (або кількості мілімолей в одному мілілітрі). У об’ємному аналізі практичним підходом є визначення титру розчину, який є кількістю грамів розчиненої речовини на мілілітр. Це особливо корисно в рутинних серійних аналізах, де результат зазвичай надається в грамах. У таких випадках достатньо помножити кількість мілілітрів препарату під час титрування на титр.
Приготування стандартних розчинів
Стандартні розчини можна приготувати різними способами. Ми можемо використовувати готові комерційно доступні так звані фіксанали (докладніше про цей метод можна прочитати далі в статті), приготувати розчин із точної маси зразка, виконати титрування іншим розчином відомої концентрації або титрувати проти точна маса зразка еталонної речовини. Точне приготування стандартних розчинів і точне регулювання їх титру (тобто визначення точної концентрації) є важливим, особливо при об’ємному аналізі.
Приготування стандартного розчину з точної проби
Основним і найпростішим способом приготування стандартного розчину є виготовлення його з точної маси еталонної речовини. У більшості випадків готують водні розчини солей. Не кожен склад підійде. Еталонна речовина повинна відповідати ряду умов:
- його чистота повинна бути не менше 99,99%;
- вона повинна бути стабільною речовиною, що означає, що вона не може розкладатися у водному розчині протягом певного періоду часу;
- при зберіганні в атмосферних умовах не вбирає воду (не гігроскопічний) і вуглекислий газ;
- еталонна речовина повинна реагувати строго по одній реакції.
Прикладами стандартних речовин є: карбонат натрію (Na 2 CO 3 ) , бромат калію (KBrO 3 ), хлорид натрію (NaCl). Ретельно підготовлену пробу стандартної речовини (маса відома з точністю до десятитисячних) розчиняють у певному об’ємі дистильованої води. Для цього використовують мірні колби з рискою на шийці, які закривають верхньою частиною. враховуючи меніск. Не забувайте кілька разів ретельно промивати дистильованою водою посудину, в якій зважували еталонну речовину (кількісне перенесення маси зразка в мірну колбу).
Приготування розчину з орієнтовною концентрацією та доведенням титру до проби стандартної речовини
У цьому випадку готують розчин приблизної концентрації, наприклад, шляхом розчинення менш точної маси в дистильованій воді. Потім нею проводять кілька титрувань (зазвичай для отримання достовірних результатів роблять три повтори, і вони не повинні істотно відрізнятися) відповідного розміру стандартної речовини. Знаючи об’єм відкоригованого розчину, який використовується для титрування проби, розраховують точну концентрацію стандартного розчину.
Титрування до іншого стандартного розчину
Точну концентрацію розчину також можна визначити порівняно з іншим стандартним розчином. Вимірюють точні об’єми титрованого розчину та титрують за індикатором. Потім за формулою визначають молярну концентрацію. 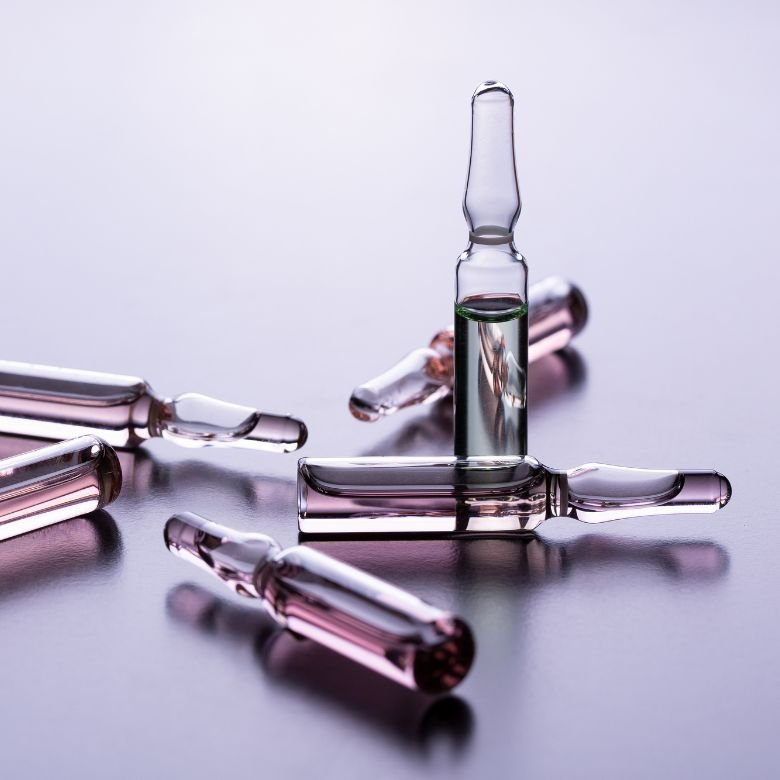
Фіксанали
Зручним способом приготування стандартних розчинів є їх приготування з використанням так званих фіксаналів. Фіксанал – це точна аналітична маса (тверда або у вигляді розчину), яка укладена в ампулу зі скла або пластику. Форма ампули сприяє точному перенесенню вмісту в мірну колбу. Їх можна легко придбати у продажу. Розчини, приготовані з використанням фіксаналів, не потребують додаткового титрування і можуть бути успішно використані в багатьох об’ємних аналізах. Для забезпечення точної концентрації розчину, отриманого з вмісту ампули, слід приділяти особливу увагу правильному переміщенню вмісту в колбу. Йдеться не лише про акуратне виливання вмісту. Необхідно переконатися в чистоті скла, кілька разів промити ампулу і кількісно перенести змиви, а також долити мірну колбу до мітки з урахуванням меніска. Вміст фіксаналу вказується виробником і вказується на етикетці. Зазвичай це кількість, розрахована на 1 літр. Таким чином, використовуючи такий готовий продукт, отримують 1 дм 3 стандартного розчину.

