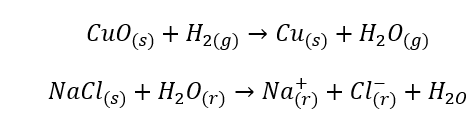Les délibérations sur divers phénomènes et processus doivent être multicouches. Nous devons tenir compte à la fois des propriétés microscopiques et macroscopiques. Comme les noms l'indiquent, cette division est faite en séparant les ordres de grandeur des éléments analysés. Le domaine macroscopique, étroitement lié à la thermodynamique des réactions chimiques, permet d'observer et de mesurer des propriétés physiques et chimiques telles que la densité, la température ou la solubilité. Par analyse microscopique, nous pouvons observer les mouvements et les interactions des molécules. Nous pouvons décrire les molécules en termes de vitesse et d'énergie cinétique. Si nous nous intéressons à un mélange, nous pouvons tenir compte de son homogénéité et, par conséquent, du type de système dans lequel il existe.

Classification des systèmes physico-chimiques
Lors de l’analyse de l’homogénéité des systèmes matériels, l’échelle macroscopique les classe en deux groupes principaux : les systèmes homogènes et hétérogènes. Cette catégorisation se fait par leurs caractéristiques physiques : l’état physique, la solubilité et le point de fusion, qui peuvent différer ou non. Chaque système comprend toutes les substances qui participent à une réaction ou à un processus particulier. La partie du système qui se démarque clairement en conservant les mêmes propriétés est appelée phase. Il existe trois types de phases différentes : solide, liquide et gazeuse. La surface située entre eux et le reste du système s’appelle l’interface. Selon l’enthalpie libre (ΔG) ou l’entropie (ΔS), si ΔS>0 ou ΔG<0, la transformation d’une phase en une autre peut se faire automatiquement.
Diagramme d’équilibre de phase
Une représentation graphique de l’existence de différentes phases est appelée le diagramme d’équilibre de phase. Il comprend l’existence de phases spécifiques (si certaines plages de température et de pression sont atteintes) et leurs conversions mutuelles. Un diagramme d’équilibre de phase schématique pour un système à un composant illustre l’existence de trois phases principales en fonction des conditions du procédé. Les lignes qu’il montre indiquent les états d’équilibre entre deux phases respectives, c’est-à-dire entre solide et gaz, entre solide et liquide, et entre gaz et liquide. Ainsi, si nous connaissons l’un des paramètres critiques, nous pouvons déterminer les conditions qui provoqueront la fusion, la congélation, l’évaporation, la condensation, la sublimation ou la resublimation de l’ingrédient en question. De plus, le diagramme comprend un point triple où toutes les lignes de phase se connectent, ce qui indique que les trois phases peuvent coexister dans des conditions spécifiées. Le diagramme comprend également deux points importants : la pression critique et la température critique. La pression critique est indiquée par le point représentant la pression maximale à laquelle on peut transformer un liquide en gaz, ou la pression maximale possible de vapeur saturée au-dessus du liquide. Le concept de température critique définit la température la plus élevée à laquelle un gaz peut se condenser lorsque la pression augmente. Par conséquent, le point critique existant dans des conditions de température et de pression critiques définit un état dans lequel les phases liquide et gazeuse sont impossibles à différencier.
Règle de phase de Gibbs
C’est une relation spécifique qui peut s’appliquer à tout système existant en équilibre thermodynamique. L’équation représentant cette règle contient le nombre de phases (f) présentes dans le système avec le nombre de constituants indépendants (n) et le nombre de degrés de liberté (s). Le nombre s correspond à la quantité de variables intensives ajustables qui, si elles sont modifiées, ne perturberont pas le nombre de phases dans l’équilibre du système isolé. Les variables intensives sont toutes les valeurs physiques qui ne dépendent en rien du système (par exemple, les tailles géométriques ou le volume) ou du nombre de ses molécules, de son poids, de sa chaleur spécifique, etc. L’équation est la suivante : Les composants indépendants du système , désigné par n, représente pratiquement le plus petit nombre de composants du système requis pour construire chacune de ses phases en toute quantité. Si nous analysons un système dont les composants peuvent réagir les uns avec les autres, nous calculons la valeur n en soustrayant le nombre d’équations de réaction indépendantes du nombre total de composants qui forment le système. Ainsi, si nous supposons la notation suivante : ![]() le nombre d’équations indépendantes est 1 – nous examinons une réaction particulière qui se produit dans le système. Une équation indépendante est tout système d’équations chimiques dans lequel il est impossible d’obtenir l’une d’elles en combinant les autres. Alors que le nombre de composants pour un tel système est de 3 : ce sont CaCO 3 , CaO et CO 2 . Cette information permet également de calculer le nombre de composantes indépendantes : n = le nombre de composantes – le nombre d’équations indépendantes, et donc : n = 3 – 1 = 2 On peut utiliser le même exemple pour calculer le nombre de degrés de liberté en utilisant l’équation de la règle de phase de Gibbs : s = n – f + 2 = 2 – 3 + 2 = 1 Cette valeur indique que pour maintenir une quantité stable de phases à l’équilibre du système, on ne peut opérer qu’une seule variable intensive.
le nombre d’équations indépendantes est 1 – nous examinons une réaction particulière qui se produit dans le système. Une équation indépendante est tout système d’équations chimiques dans lequel il est impossible d’obtenir l’une d’elles en combinant les autres. Alors que le nombre de composants pour un tel système est de 3 : ce sont CaCO 3 , CaO et CO 2 . Cette information permet également de calculer le nombre de composantes indépendantes : n = le nombre de composantes – le nombre d’équations indépendantes, et donc : n = 3 – 1 = 2 On peut utiliser le même exemple pour calculer le nombre de degrés de liberté en utilisant l’équation de la règle de phase de Gibbs : s = n – f + 2 = 2 – 3 + 2 = 1 Cette valeur indique que pour maintenir une quantité stable de phases à l’équilibre du système, on ne peut opérer qu’une seule variable intensive. 
Systèmes hétérogènes
Tout système qui comprend plus d’une phase (donc un système non homogène) est également hétérogène. Le type des phases n’a pas d’importance ; un système hétérogène peut contenir à la fois plusieurs phases solides et liquides mais une seule phase gazeuse. Cela est dû au fait que les gaz se mélangent parfaitement. Un exemple intéressant de système hétérogène est le granit – il contient de nombreuses phases solides, notamment du quartz, du feldspath potassique, du plagioclase et de la biotite. De nombreux produits alimentaires peuvent également être qualifiés d’hétérogènes, des exemples parfaits étant le muesli multi-ingrédients ou les sauces à salade composées de matières grasses, d’épices et d’autres additifs. Un type intéressant de mélanges non homogènes sont les colloïdes (solutions dont les constituants ne peuvent être distingués qu’au microscope). Cependant, dans la plupart des cas, ils peuvent être séparés avec des méthodes ou des outils simples. Par exemple, pour séparer un mélange composé d’eau et d’huile, nous pouvons utiliser la décantation – les ingrédients seront visibles à l’œil nu. D’autres méthodes que nous pouvons utiliser pour séparer efficacement des mélanges non homogènes incluent : la filtration, la ségrégation mécanique ou la centrifugation. Il en va de même pour un mélange de minéraux aux propriétés différentes : le quartz, le mica et le feldspath peuvent être séparés même avec un marteau.
Systèmes homogènes
Contrairement aux systèmes hétérogènes, un système homogène se caractérise par la présence d’une seule phase. Dans un tel cas, on ne peut pas distinguer les constituants à l’œil nu. Les méthodes simples de séparation sont également inefficaces, et seules les méthodes basées sur les caractéristiques physiques peuvent s’avérer utiles. Un exemple d’un tel procédé est la séparation par distillation, qui est basée sur des points d’ébullition diversifiés d’un système spécifique. D’autres méthodes efficaces pour séparer des mélanges homogènes sont la cristallisation et la chromatographie. Un type particulier de système homogène est une substance pure dont la seule phase ne contient qu’un seul composant. Un autre exemple sont tous les types de solutions et de mélanges homogènes – malgré la présence d’une seule phase, le système peut inclure de nombreux composants. Comme la phase présente dans le système peut être un liquide, un solide ou un gaz, les solutions peuvent également prendre de telles formes. Des exemples de tels systèmes sont des mélanges liquides (vinaigre, eau), des mélanges gazeux (air atmosphérique) et des mélanges solides, y compris des minerais et tous types d’alliages, tels que le bronze ou le laiton.
Transitions dans les systèmes
Deux types de transitions peuvent se produire dans les systèmes, à savoir les transitions de phase (parfois appelées physiques) et chimiques. Les premières incluent toutes les transitions qui ne produisent pas de nouvelles substances chimiques. Ils ne se caractérisent pas non plus par la décoloration des composants déjà présents. Cependant, comme leur nom l’indique, ils entraînent de tels changements dans la structure ou l’état physique. Il est également possible qu’une nouvelle phase se forme alors que la phase d’origine s’estompe. Des exemples de transitions de phase comprennent la resublimation et les transitions polymorphes d’éléments. Les transitions chimiques montrent un mécanisme complètement différent. Ce sont des réactions qui produisent de nouvelles substances qui remplacent les constituants d’origine. De telles transitions peuvent être réalisées selon deux variantes, par exemple lors de l’hydrolyse en une ou plusieurs phases ainsi que lors de la combustion.
Réactions chimiques
- Des réactions homogènes se produisent lorsque l’ensemble du système, y compris les substrats et les produits, est en une seule phase, par exemple :
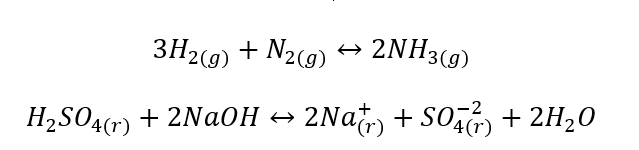
- Les réactions hétérogènes sont de telles réactions où le système, y compris les substrats et les produits, est au moins dans deux phases différentes. De telles réactions se produisent toujours à l’interface, par exemple :