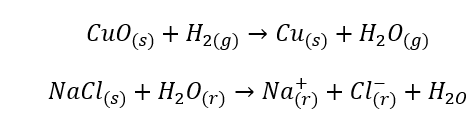Överväganden om olika fenomen och processer måste vara mångskiktade. Vi bör ta hänsyn till både de mikroskopiska och makroskopiska egenskaperna. Som namnen antyder görs denna uppdelning genom att separera storleksordningarna för de analyserade objekten. Den makroskopiska domänen, nära kopplad till termodynamiken för kemiska reaktioner, tillåter oss att observera och mäta fysikaliska och kemiska egenskaper såsom densitet, temperatur eller löslighet. Genom mikroskopisk analys kan vi observera molekylers rörelser och interaktioner. Vi kan beskriva molekyler i termer av deras hastighet och kinetiska energi. Om vi är intresserade av en blandning kan vi ta hänsyn till dess homogenitet och följaktligen vilken typ av system den finns i.

Klassificering av fysikalisk-kemiska system
När man analyserar materialsystemens homogenitet klassificerar den makroskopiska skalan dem i två huvudgrupper: homogena och heterogena system. Denna kategorisering är efter deras fysiska egenskaper: det fysiska tillståndet, lösligheten och smältpunkten, som kan skilja sig åt eller inte. Varje system inkluderar alla ämnen som deltar i en viss reaktion eller process. Den del av systemet som tydligt sticker ut genom att bibehålla samma egenskaper kallas en fas. Det finns tre olika typer av faser: fast, flytande och gas. Ytan som ligger mellan dem och resten av systemet kallas gränssnittet. Beroende på den fria entalpin (ΔG) eller entropin (ΔS), om ΔS>0 eller ΔG<0, kan omvandlingen av en fas till en annan ske automatiskt.
Fasjämviktsdiagram
En grafisk representation av förekomsten av olika faser kallas fasjämviktsdiagrammet. Det inkluderar förekomsten av specifika faser (om vissa temperatur- och tryckintervall uppnås) och deras inbördes omvandlingar. Ett schematiskt fasjämviktsdiagram för ett enkomponentsystem illustrerar förekomsten av tre huvudfaser beroende på processförhållandena. Linjerna den visar indikerar jämviktstillstånden mellan två respektive faser, det vill säga mellan fast och gas, mellan fast och flytande, och mellan gas och vätska. Således, om vi känner till en av de kritiska parametrarna, kan vi bestämma de förhållanden som kommer att orsaka smältning, frysning, avdunstning, kondensering, sublimering eller återsublimering av ingrediensen i fråga. Dessutom inkluderar diagrammet en trippelpunkt där alla faslinjer ansluter, vilket indikerar att alla tre faserna kan samexistera under specificerade förhållanden. Diagrammet innehåller också två viktiga punkter: kritiskt tryck och kritisk temperatur. Det kritiska trycket indikeras av punkten som representerar det maximala trycket vid vilket vi kan omvandla en vätska till en gas, eller det maximalt möjliga trycket av mättad ånga ovanför vätskan. Begreppet kritisk temperatur definierar den högsta temperaturen vid vilken en gas kan kondensera när trycket ökar. Därför definierar den kritiska punkten som existerar vid kritiska temperatur- och kritiska tryckförhållanden ett tillstånd i vilket vätske- och gasfaserna är omöjliga att skilja åt.
Gibbs fasregel
Det är ett specifikt förhållande som kan tillämpas på alla system som existerar i termodynamisk jämvikt. Ekvationen som representerar den regeln innehåller antalet faser (f) som finns i systemet med antalet oberoende beståndsdelar (n) och antalet frihetsgrader (s). s-talet motsvarar mängden justerbara intensiva variabler som, om de ändras, inte kommer att störa antalet faser i det isolerade systemets jämvikt. Intensiva variabler är alla fysiska värden som inte på något sätt beror på systemet (t.ex. geometriska storlekar eller volym) eller på antalet molekyler, dess vikt, specifik värme, etc. Ekvationen är följande: Systemets oberoende komponenter , betecknad som n, representerar praktiskt taget det lägsta antalet systemkomponenter som krävs för att bygga var och en av dess faser i någon kvantitet. Om vi analyserar ett system vars komponenter kan reagera med varandra, beräknar vi n-värdet genom att subtrahera antalet oberoende reaktionsekvationer från det totala antalet komponenter som bildar systemet. Alltså, om vi antar följande notation: ![]() antalet oberoende ekvationer är 1 – vi undersöker en viss reaktion som sker i systemet. En oberoende ekvation är varje system av kemiska ekvationer där det är omöjligt att få någon av dem genom att kombinera de andra. Medan antalet komponenter för ett sådant system är 3: de är CaCO 3 , CaO och CO 2 . Denna information låter oss också beräkna antalet oberoende komponenter: n = antalet komponenter – antalet oberoende ekvationer, och därmed: n = 3 – 1 = 2 Vi kan använda samma exempel för att beräkna antalet frihetsgrader med hjälp av ekvationen för Gibbs fasregel: s = n – f + 2 = 2 – 3 + 2 = 1 Detta värde indikerar att för att upprätthålla en stabil mängd faser i systemjämvikt kan vi endast använda en intensiv variabel.
antalet oberoende ekvationer är 1 – vi undersöker en viss reaktion som sker i systemet. En oberoende ekvation är varje system av kemiska ekvationer där det är omöjligt att få någon av dem genom att kombinera de andra. Medan antalet komponenter för ett sådant system är 3: de är CaCO 3 , CaO och CO 2 . Denna information låter oss också beräkna antalet oberoende komponenter: n = antalet komponenter – antalet oberoende ekvationer, och därmed: n = 3 – 1 = 2 Vi kan använda samma exempel för att beräkna antalet frihetsgrader med hjälp av ekvationen för Gibbs fasregel: s = n – f + 2 = 2 – 3 + 2 = 1 Detta värde indikerar att för att upprätthålla en stabil mängd faser i systemjämvikt kan vi endast använda en intensiv variabel. 
Heterogena system
Alla system som inkluderar mer än en fas (alltså ett icke-homogent system) är också heterogent. Typen av faserna är irrelevant; ett heterogent system kan samtidigt innehålla flera fasta och flytande faser men bara en gasfas. Detta beror på att gaser blandas på ett perfekt sätt. Ett intressant exempel på ett heterogent system är granit – den innehåller många fasta faser, inklusive kvarts, kaliumfältspat, plagioklas och biotit. Många livsmedelsprodukter kan också kallas heterogena, perfekta exempel är müsli med flera ingredienser eller salladssåser som består av fett, kryddor och andra tillsatser. En intressant typ av icke-homogena blandningar är kolloider (lösningar vars beståndsdelar endast kan urskiljas med ett mikroskop). Men i de flesta fall kan de separeras med enkla metoder eller verktyg. För att till exempel separera en blandning bestående av vatten och olja kan vi använda dekantering – ingredienserna kommer att vara synliga för blotta ögat. Andra metoder vi kan använda för att effektivt separera icke-homogena blandningar inkluderar: filtrering, mekanisk segregering eller centrifugering. Det är liknande för en blandning av mineraler som skiljer sig i egenskaper: kvarts, glimmer och fältspat kan separeras även med en hammare.
Homogena system
Till skillnad från heterogena system kännetecknas ett homogent system av närvaron av endast en fas. I ett sådant fall kan vi inte särskilja beståndsdelarna med blotta ögat. Enkla metoder för separation är också ineffektiva, och endast metoder baserade på fysiska egenskaper kan visa sig vara användbara. Ett exempel på en sådan metod är separationen genom destillation, som är baserad på diversifierade kokpunkter för ett specifikt system. Andra metoder som är effektiva för att separera homogena blandningar är kristallisation och kromatografi. En speciell typ av ett homogent system är ett rent ämne vars enda fas endast innehåller en komponent. Ett annat exempel är alla typer av homogena lösningar och blandningar – trots närvaron av endast en fas kan systemet innehålla många komponenter. Eftersom fasen som finns i systemet kan vara en vätska, en fast substans eller en gas, kan lösningar också ta sådana former. Exempel på sådana system är flytande blandningar (vinäger, vatten), gasblandningar (atmosfärisk luft) och fasta blandningar, inklusive mineralmalmer och alla typer av legeringar, såsom brons eller mässing.
Övergångar i system
Två typer av övergångar kan förekomma i system, dessa är fas (ibland kallade fysiska) och kemiska övergångar. De förra omfattar alla övergångar som inte ger nya kemiska ämnen. De kännetecknas inte heller av blekningen av de komponenter som redan finns. Men som namnet indikerar leder de till sådana förändringar i strukturen eller det fysiska tillståndet. Det är också möjligt att en ny fas kommer att bildas medan den ursprungliga fasen tonar ut. Exempel på fasövergångar inkluderar återsublimering och polymorfa övergångar av element. Kemiska övergångar visar en helt annan mekanism. Dessa är reaktioner som producerar nya ämnen som ersätter de ursprungliga beståndsdelarna. Sådana övergångar kan utföras i två varianter, till exempel under hydrolys i en eller flera faser samt under förbränning.
Kemiska reaktioner
- Homogena reaktioner uppstår när hela systemet, inklusive substrat och produkter, är i en fas, till exempel:
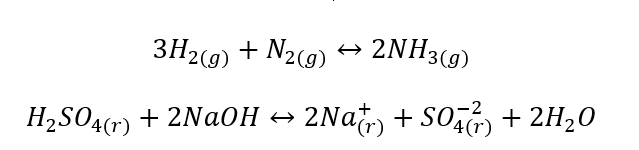
- Heterogena reaktioner är sådana reaktioner där systemet, inklusive substrat och produkter, är åtminstone i två olika faser. Sådana reaktioner inträffar alltid i gränssnittet, till exempel: