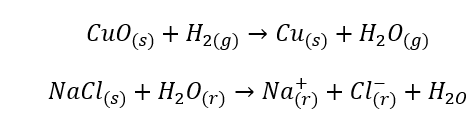Роздуми про різноманітні явища та процеси мають бути багатошаровими. Слід враховувати як мікроскопічні, так і макроскопічні властивості. Як випливає з назви, цей поділ здійснюється шляхом відокремлення порядків величин аналізованих елементів. Макроскопічна область, тісно пов’язана з термодинамікою хімічних реакцій, дозволяє нам спостерігати та вимірювати фізичні та хімічні властивості, такі як густина, температура або розчинність. За допомогою мікроскопічного аналізу ми можемо спостерігати рух і взаємодію молекул. Ми можемо описати молекули з точки зору їх швидкості та кінетичної енергії. Якщо нас цікавить суміш, ми можемо взяти до уваги її однорідність і, отже, тип системи, в якій вона існує.

Класифікація фізико-хімічних систем
При аналізі однорідності матеріальних систем макроскопічна шкала поділяє їх на дві основні групи: однорідні та гетерогенні системи. Ця класифікація здійснюється за їхніми фізичними характеристиками: фізичним станом, розчинністю та температурою плавлення, які можуть відрізнятися чи ні. Кожна система включає всі речовини, які беруть участь у певній реакції чи процесі. Частина системи, яка чітко виділяється, зберігаючи однакові властивості, називається фазою. Існує три різних типи фаз: тверда, рідка і газоподібна. Поверхня, розташована між ними та рештою системи, називається межею розділу. Залежно від вільної ентальпії (ΔG) або ентропії (ΔS), якщо ΔS>0 або ΔG<0, перетворення однієї фази в іншу може відбуватися автоматично.
Діаграма фазової рівноваги
Графічне зображення існування різних фаз називається діаграмою фазової рівноваги. Він включає наявність певних фаз (якщо досягаються певні діапазони температури і тиску) і їх взаємні перетворення. Схематична діаграма фазової рівноваги для однокомпонентної системи ілюструє існування трьох основних фаз залежно від умов процесу. Лінії, які він показує, вказують на стани рівноваги між двома відповідними фазами, тобто між твердою речовиною та газом, між твердою речовиною та рідиною та між газом та рідиною. Таким чином, якщо ми знаємо один із критичних параметрів, ми можемо визначити умови, які спричинять плавлення, замерзання, випаровування, конденсацію, сублімацію або повторну сублімацію відповідного інгредієнта. Крім того, діаграма містить потрійну точку, де з’єднуються всі фазові лінії, що вказує на те, що всі три фази можуть співіснувати в певних умовах. Діаграма також включає два важливі моменти: критичний тиск і критичну температуру. Критичний тиск позначається точкою, що представляє максимальний тиск, при якому ми можемо перетворити рідину на газ, або максимально можливий тиск насиченої пари над рідиною. Поняття критичної температури визначає найвищу температуру, при якій газ може конденсуватися під час підвищення тиску. Таким чином, критична точка, що існує за умов критичної температури та критичного тиску, визначає стан, у якому рідку та газоподібну фази неможливо розрізнити.
Правило фази Гіббса
Це специфічне співвідношення, яке можна застосувати до будь-якої системи, що існує в термодинамічній рівновазі. Рівняння, що представляє це правило, містить кількість фаз (f), присутніх у системі з кількістю незалежних складових (n) і кількістю ступенів свободи (s). Число s відповідає кількості регульованих інтенсивних змінних, які, якщо їх змінити, не порушують кількість фаз у рівновазі ізольованої системи. Інтенсивні змінні – це будь-які фізичні величини, які жодним чином не залежать від системи (наприклад, геометричні розміри чи об’єм) або від кількості її молекул, її ваги, питомої теплоємності тощо. Рівняння має такий вигляд: Незалежні компоненти системи , позначені як n, практично представляють найменшу кількість компонентів системи, необхідних для побудови кожної з її фаз у будь-якій кількості. Якщо ми аналізуємо систему, компоненти якої можуть реагувати один з одним, ми обчислюємо значення n, віднімаючи кількість незалежних рівнянь реакції із загальної кількості компонентів, які утворюють систему. Таким чином, якщо прийняти такі позначення: ![]() кількість незалежних рівнянь 1 – досліджуємо конкретну реакцію, яка відбувається в системі. Незалежне рівняння — це будь-яка система хімічних рівнянь, у якій неможливо отримати жодне з них шляхом поєднання інших. Тоді як кількість компонентів такої системи становить 3: це CaCO 3 , CaO і CO 2 . Ця інформація також дозволяє нам обчислити кількість незалежних компонентів: n = кількість компонентів – кількість незалежних рівнянь, отже: n = 3 – 1 = 2 Ми можемо використати той самий приклад для розрахунку кількості ступенів свободи. використовуючи рівняння для правила фази Гіббса: s = n – f + 2 = 2 – 3 + 2 = 1 Це значення вказує на те, що для підтримки стабільної кількості фаз у рівновазі системи ми можемо оперувати лише однією інтенсивною змінною.
кількість незалежних рівнянь 1 – досліджуємо конкретну реакцію, яка відбувається в системі. Незалежне рівняння — це будь-яка система хімічних рівнянь, у якій неможливо отримати жодне з них шляхом поєднання інших. Тоді як кількість компонентів такої системи становить 3: це CaCO 3 , CaO і CO 2 . Ця інформація також дозволяє нам обчислити кількість незалежних компонентів: n = кількість компонентів – кількість незалежних рівнянь, отже: n = 3 – 1 = 2 Ми можемо використати той самий приклад для розрахунку кількості ступенів свободи. використовуючи рівняння для правила фази Гіббса: s = n – f + 2 = 2 – 3 + 2 = 1 Це значення вказує на те, що для підтримки стабільної кількості фаз у рівновазі системи ми можемо оперувати лише однією інтенсивною змінною. 
Гетерогенні системи
Будь-яка система, яка включає більше ніж одну фазу (тому неоднорідна система), також є гетерогенною. Тип фаз не має значення; гетерогенна система може одночасно містити кілька твердих і рідких фаз, але тільки одну газоподібну. Це пов’язано з тим, що гази ідеально змішуються. Цікавим прикладом гетерогенної системи є граніт – він містить багато твердих фаз, включаючи кварц, калієвий польовий шпат, плагіоклаз і біотит. Багато харчових продуктів також можна назвати гетерогенними, найкращими прикладами є багатокомпонентні мюслі або соуси для салатів, які складаються з жиру, спецій та інших добавок. Цікавим видом неоднорідних сумішей є колоїди (розчини, складові яких можна розрізнити лише за допомогою мікроскопа). Однак у більшості випадків їх можна розділити за допомогою простих методів або інструментів. Наприклад, щоб розділити суміш, що складається з води та олії, ми можемо скористатися декантацією – інгредієнти будуть видні неозброєним оком. Інші методи, які ми можемо використовувати для ефективного розділення неоднорідних сумішей, включають: фільтрацію, механічну сегрегацію або центрифугування. Аналогічно і для суміші різних за властивостями мінералів: кварц, слюду і польовий шпат можна розділити навіть молотком.
Однорідні системи
На відміну від гетерогенних систем, гомогенна система характеризується наявністю лише однієї фази. У такому випадку ми не можемо розрізнити складові неозброєним оком. Прості методи поділу також неефективні, а корисними можуть виявитися лише методи, засновані на фізичних характеристиках. Прикладом такого методу є розділення за допомогою дистиляції, яке базується на різноманітних температурах кипіння конкретної системи. Іншими методами, ефективними для розділення однорідних сумішей, є кристалізація та хроматографія. Особливим типом однорідної системи є чиста речовина, єдина фаза якої містить лише один компонент. Іншим прикладом є всі види однорідних розчинів і сумішей – незважаючи на наявність лише однієї фази, система може включати багато компонентів. Оскільки фаза, присутня в системі, може бути рідиною, твердою речовиною або газом, розчини також можуть мати такі форми. Прикладами таких систем є рідкі суміші (оцет, вода), газоподібні суміші (атмосферне повітря) і тверді суміші, включаючи мінеральні руди та всі види сплавів, таких як бронза або латунь.
Переходи в системах
У системах можуть відбуватися два типи переходів, це фазові (іноді їх називають фізичними) і хімічні переходи. До перших належать усі переходи, які не утворюють нових хімічних речовин. Для них також не характерне вицвітання вже наявних компонентів. Однак, як вказує назва, вони призводять до таких змін у структурі або фізичному стані. Також можливо, що нова фаза буде сформована, тоді як початкова фаза зникне. Приклади фазових переходів включають повторну сублімацію та поліморфні переходи елементів. Хімічні переходи демонструють зовсім інший механізм. Це реакції, під час яких утворюються нові речовини, які замінюють вихідні складові. Такі переходи можуть здійснюватися у двох варіантах, наприклад під час гідролізу в одній або кількох фазах, а також під час спалювання.
Хімічні реакції
- Гомогенні реакції відбуваються, коли вся система, включаючи субстрати та продукти, знаходиться в одній фазі, наприклад:
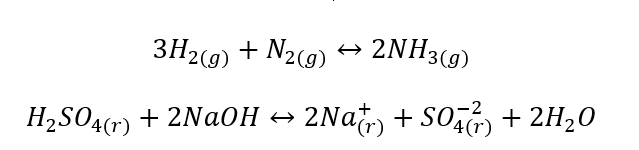
- Гетерогенні реакції – це такі реакції, в яких система, включаючи субстрати та продукти, знаходиться щонайменше у двох різних фазах. Такі реакції завжди відбуваються на межі розділу, наприклад: