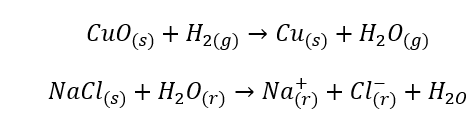Rozważania na temat zjawisk i procesów muszą być wielowarstwowe. Należy wziąć pod uwagę właściwości natury mikroskopowej oraz makroskopowej. Jak wskazują same nazwy, podział ten odbywa się za pomocą rozdziału rzędów wielkości analizowanych elementów. Dziedzina makroskopowa, ściśle powiązana z termodynamiką reakcji chemicznych, pozwala na obserwację oraz pomiar właściwości fizycznych oraz chemicznych, takich jak na przykład gęstość, temperatura czy też rozpuszczalność. W przypadku analizy mikroskopowej, możliwe do obserwacji są ruchy cząsteczek oraz wzajemne ich oddziaływanie. Możemy opisać cząsteczki pod względem ich prędkości oraz energii kinetycznej. W przypadku, kiedy naszym obszarem zainteresowania jest mieszanina, musimy wziąć pod uwagę jej jednorodność, a co za tym idzie – rodzaj układu, w którym występuje.

Klasyfikacja układów fizykochemicznych
W trakcie rozważania jednorodności układów materialnych, w skali makroskopowej istnieje podział na dwie główne grupy – układów heterogenicznych oraz homogenicznych. Jest to kategoryzacja, według ich właściwości fizycznych – stanu skupienia, rozpuszczalności, temperatury topnienia, które różnią się lub nie. W skład każdego układu wchodzą wszystkie, uczestniczące w reakcji czy też procesie, substancje. Odznaczająca się wyraźnie część układu, charakteryzująca się zachowaniem takich samych właściwości, nazywana jest fazą. Istnieją trzy podstawowe rodzaje faz – ciało stałe, ciecz oraz gaz. Znajdująca się pomiędzy nimi, a resztą układu powierzchnia stanowi granicę faz. W zależności od entropii (ΔS) lub entalpii swobodnej (ΔG), jeżeli ΔS>0 lub ΔG<0, przechodzenie faz z jednej w drugą może zachodzić samorzutnie.
Diagram fazowy
Graficznym odzwierciedleniem występowania różnych faz jest diagram fazowy. Uwzględnia on występowanie danych faz, w przypadku osiągania pewnych zakresów temperaturowych oraz ciśnienia, a także ich wzajemnych przemian. Schematyczny diagram fazowy dla jednoskładnikowego układu ilustruje istnienie trzech głównych faz w zależności od warunków prowadzenia procesu. Obecne na nim linie wskazują na stany równowagi pomiędzy odpowiednimi dwoma fazami, to znaczy pomiędzy ciałem stałym i gazem, ciałem stałym i cieczą oraz gazem i cieczą. Znając jeden z krytycznych parametrów możemy więc określić w jakich warunkach nastąpi topnienie, krzepnięcie, parowanie, skraplanie, sublimacja oraz resublimacja opisanego składnika. Ponadto, na wykresie obecny jest punkt potrójny, w którym wszystkie linie faz się łączą oznaczając możliwość współistnienia trzech faz jednocześnie, w określonych warunkach. Diagram zawiera również dwa, bardzo ważne punkty – ciśnienia krytycznego oraz temperatury krytycznej. Ciśnienie krytyczne wyznacza punkt odzwierciedlający maksymalne ciśnienie, pod którym można przeprowadzić ciecz w gaz lub największe możliwe ciśnienie pary nasyconej nad cieczą. Natomiast pojęcie temperatury krytycznej określa najwyższą temperaturę, w której możliwe jest skroplenie gazu, wraz ze wzrostem ciśnienia. Punkt krytyczny, znajdujący się w warunkach temperatury krytycznej oraz ciśnienia krytycznego, opisuje więc stan, w którym faza ciekła i gazowa są niemożliwe do rozróżnienia.
Reguła faz Gibbsa
Jest to specyficzna zależność, której zastosowanie dotyczy każdego układu występującego w równowadze termodynamicznej. Równanie, określające tę regułę, zawiera w sobie obecną w układzie liczbę faz (f) z liczbą niezależnych składników (n) oraz liczbą stopni swobody (s). Liczba s odpowiada ilości możliwych do dostosowania zmiennych intensywnych, których zmiana nie doprowadzi do zaburzenia liczby faz w równowadze układu izolowanego. Zmiennymi intensywnymi nazywamy wszelkie wielkości fizyczne, które nie są zależne w żaden sposób od układu, na przykład rozmiary geometryczne i objętość, a także od liczby cząsteczek układu, jego masy, ciepła właściwego i tym podobnych. Równanie przyjmuje postać:
s = n – f + 2
Oznaczone literą n niezależne składniki układu, w praktyce oznaczają najmniejszą liczbę składników rozważanego układu, która jest konieczna aby możliwe było zbudowanie każdej z jego faz w dowolnej ilości. Jeżeli rozpatrujemy układ, którego składniki mogą ze sobą reagować, obliczenie liczby n odbywa się poprzez odjęcie liczby niezależnych równań reakcji od ogólnej liczby składników, tworzących dany układ. To znaczy, jeżeli dla reakcji przyjmującej zapis:
![]()
liczba niezależnych równań wynosi 1 – rozpatrujemy konkretną reakcję zachodzącą w układzie. Niezależnym równaniem nazywamy każdy układ równań chemicznych, w którym niemożliwe jest otrzymanie żadnego z nich, poprzez kombinację pozostałych. Natomiast liczba składników dla tego układu to 3, obecne są CaCO3, CaO oraz CO2. Dzięki tym informacjom możemy obliczyć również liczbę składników niezależnych:
n = liczba składników – liczba równań niezależnych, a więc:
n = 3 – 1 = 2
Na tym samym przykładnie możemy również obliczyć liczbę stopni swobody, z wykorzystaniem równania na regułę faz Gibbsa:
s = n – f + 2 = 2 – 3 + 2 = 1
Ta wartość oznacza, że w celu zachowania stabilności ilości liczby faz w równowadze układu, możemy operować jedynie jedną zmienną intensywną.

Układ heterogeniczny
Każdy układ, w którym istnieje więcej niż jedna faza, a więc układ niejednorodny jest również heterogenicznym. Nie jest istotne jakiego rodzaju są to fazy – heterogeniczny układ może zawierać jednocześnie kilka faz stałych, ciekłych, ale jedynie jedną fazę gazową. Jest to spowodowane faktem, iż gazy ulegają wymieszaniu w sposób idealny.
Ciekawym przykładem układu heterogenicznego jest granit – posiada on wiele faz stałych, w tym kwarc, skaleń potasowy, plagioklaz oraz biotyt. Wiele produktów spożywczych również można nazwać heterogenicznymi – wieloskładnikowe muesli, czy też sałatkowe sosy składające się z tłuszczu oraz przypraw i innych dodatków, są ich idealnymi przykładami.
Interesującym typem mieszanin niejednorodnych są koloidy, czyli roztwory, do których rozróżnienia składników konieczne jest wykorzystanie mikroskopu. W większości przypadków możliwe jest jednak rozdzielenie ich prostymi metodami lub za pomocą prostych narzędzi. Dla przykładu, w celu rozdzielenia mieszaniny składającej się z wody i oleju, możemy wykorzystać dekantację – składniki są widoczne gołym okiem. Do innych metod, skutecznych do rozdziału mieszanin niejednorodnych, należą: sączenie, segregacja mechaniczna czy wirowanie. Podobnie jest z mieszaniną minerałów, różniące się właściwościami – kwarc, mika i skaleń, mogą zostać rozdzielone nawet przy pomocy młotka.
Układ homogeniczny
W przeciwieństwie do układu heterogenicznego, homogeniczny charakteryzuje się zawartością jedynie jednej fazy – jest jednorodny. W takim przypadku, z układu nie jesteśmy w stanie gołym okiem rozróżnić składników. Również proste metody rozdziału nie są efektywne, a jedynie metody oparte na właściwościach fizycznych mogą być przydatne. Przykładem takiej metody jest rozdział z wykorzystaniem destylacji, który opiera się na zróżnicowanych temperaturach wrzenia danego układu. Innymi metodami, skutecznymi w rozdziale mieszanin jednorodnych, są krystalizacja oraz chromatografia. Szczególnym rodzajem układu homogenicznego jest substancja czysta, której jedyna faza zawiera wyłącznie jeden składnik. Innym przypadkiem są wszelkiego rodzaju roztwory i mieszaniny jednorodne – pomimo jednej fazy, układ może zawierać wiele składników. Ze względu na fakt, że obecna w układzie faza może być zarówno cieczą, jak i ciałem stałym czy gazem, roztwory również mogą przyjmować takie postacie. Przykładami tego typu układów mogą być mieszaniny płynne – ocet, woda, mieszaniny gazowe – powietrze atmosferyczne, a także mieszaniny ciał stałych, w tym rudy mineralne oraz wszelkiego rodzaju stopy, takie jak brąz czy mosiądz.
Przemiany w układach
Możliwe jest zachodzenie w układach dwóch typów przemian – fazowe, rzadziej nazywane fizycznymi oraz chemiczne. Te pierwsze to wszystkie przemiany, które nie dają skutku w postaci nowych substancji chemicznych. Nie odznaczają się również zanikaniem obecnych już składników. Jednak, jak sama nazwa wskazuje, prowadzą one do takich zmian w zakresie stanu skupienia czy też struktury. Możliwe jest też powstawanie nowej fazy z jednoczesnym zanikiem fazy pierwotnej. Przykładami przemian fazowych są resublimacja oraz przemiany polimorficzne pierwiastków. Całkowicie inny mechanizm mają przemiany chemiczne. Są to bowiem reakcje, które skutkują powstawaniem w miejscu pierwotnych składników, nowych substancji. Takie przemiany mogą przebiegać w dwóch wariantach – np. podczas hydrolizy w jednej fazie lub w kilku oraz w trakcie spalania.
Reakcje chemiczne
- Reakcje homogeniczne, nazywane też jednorodnymi, występują wtedy gdy cały układ, wraz z substratami i produktami, znajduje się w jednej fazie, np.:
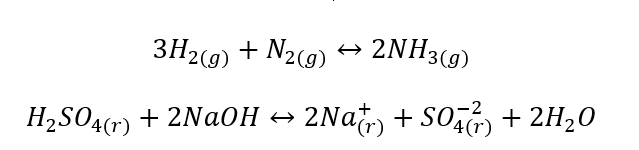
- Reakcje heterogeniczne – niejednorodne, są to reakcje na przestrzeni których układ, a w nim substraty oraz produkty, znajdują się w minimum dwóch różnych fazach. Takie reakcje zachodzą zawsze na granicy rozdziału faz, np.: