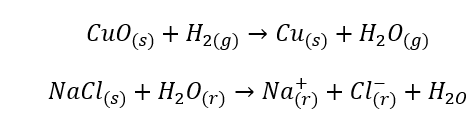Perbincangan tentang pelbagai fenomena dan proses mesti berbilang lapisan. Kita harus mengambil kira kedua-dua sifat mikroskopik dan makroskopik. Seperti namanya, pembahagian ini dibuat dengan mengasingkan susunan magnitud item yang dianalisis. Domain makroskopik, berkait rapat dengan termodinamik tindak balas kimia, membolehkan kita memerhati dan mengukur sifat fizikal dan kimia seperti ketumpatan, suhu atau keterlarutan. Dengan analisis mikroskopik, kita boleh memerhatikan pergerakan dan interaksi molekul. Kita boleh menerangkan molekul dari segi kelajuan dan tenaga kinetiknya. Jika kita berminat dengan campuran, kita boleh mengambil kira kehomogenannya dan, akibatnya, jenis sistem ia wujud.

Klasifikasi sistem fiziko-kimia
Apabila menganalisis kehomogenan sistem bahan, skala makroskopik mengklasifikasikannya kepada dua kumpulan utama: sistem homogen dan heterogen. Pengkategorian ini adalah mengikut ciri fizikalnya: keadaan fizikal, keterlarutan dan takat lebur, yang mungkin berbeza atau tidak. Setiap sistem merangkumi semua bahan yang mengambil bahagian dalam tindak balas atau proses tertentu. Bahagian sistem yang jelas menonjol dengan mengekalkan sifat yang sama dirujuk sebagai fasa. Terdapat tiga jenis fasa yang berbeza: pepejal, cecair dan gas. Permukaan yang terletak di antara mereka dan baki sistem dipanggil antara muka. Bergantung kepada entalpi bebas (ΔG) atau entropi (ΔS), jika ΔS>0 atau ΔG<0, perubahan satu fasa kepada fasa lain mungkin berlaku secara automatik.
Gambar rajah keseimbangan fasa
Perwakilan grafik kewujudan fasa yang berbeza dipanggil rajah keseimbangan fasa. Ia termasuk kewujudan fasa tertentu (jika suhu dan julat tekanan tertentu dicapai) dan penukaran bersama mereka. Gambar rajah keseimbangan fasa skematik untuk sistem satu komponen menggambarkan kewujudan tiga fasa utama bergantung kepada keadaan proses. Garisan yang ditunjukkan menunjukkan keadaan keseimbangan antara dua fasa masing-masing, iaitu antara pepejal dan gas, antara pepejal dan cecair, dan antara gas dan cecair. Oleh itu, jika kita mengetahui salah satu parameter kritikal, kita boleh menentukan keadaan yang akan menyebabkan lebur, pembekuan, penyejatan, pemeluwapan, pemejalwapan atau sublimasi semula bahan berkenaan. Selain itu, rajah termasuk titik tiga di mana semua garisan fasa bersambung, yang menunjukkan bahawa ketiga-tiga fasa boleh wujud bersama dalam keadaan tertentu. Rajah juga merangkumi dua perkara penting: tekanan kritikal dan suhu kritikal. Tekanan kritikal ditunjukkan oleh titik yang mewakili tekanan maksimum di mana kita boleh menukar cecair kepada gas, atau tekanan maksimum yang mungkin bagi wap tepu di atas cecair. Konsep suhu kritikal mentakrifkan suhu tertinggi di mana gas boleh terkondensat apabila tekanan meningkat. Oleh itu, titik kritikal yang wujud pada suhu kritikal dan keadaan tekanan kritikal mentakrifkan keadaan di mana fasa cecair dan gas adalah mustahil untuk dibezakan.
Peraturan fasa Gibbs
Ia adalah hubungan khusus yang boleh digunakan untuk mana-mana sistem yang wujud dalam keseimbangan termodinamik. Persamaan yang mewakili peraturan itu mengandungi bilangan fasa (f) yang terdapat dalam sistem dengan bilangan juzuk bebas (n) dan bilangan darjah kebebasan (s). Nombor s sepadan dengan kuantiti pembolehubah intensif boleh laras yang, jika diubah, tidak akan mengganggu bilangan fasa dalam keseimbangan sistem terpencil. Pembolehubah intensif ialah sebarang nilai fizikal yang sama sekali tidak bergantung pada sistem (cth, saiz atau isipadu geometri) atau pada bilangan molekulnya, beratnya, haba tentu, dsb. Persamaannya adalah seperti berikut: Komponen bebas sistem , ditetapkan sebagai n, secara praktikal mewakili bilangan terendah komponen sistem yang diperlukan untuk membina setiap fasanya dalam sebarang kuantiti. Jika kita menganalisis sistem yang komponennya boleh bertindak balas antara satu sama lain, kita mengira nilai n dengan menolak bilangan persamaan tindak balas bebas daripada jumlah bilangan komponen yang membentuk sistem. Oleh itu, jika kita menganggap notasi berikut: ![]() bilangan persamaan bebas ialah 1 – kita meneliti tindak balas tertentu yang berlaku dalam sistem. Persamaan bebas ialah sebarang sistem persamaan kimia di mana mustahil untuk mendapatkan mana-mana daripadanya dengan menggabungkan yang lain. Manakala bilangan komponen untuk sistem sedemikian ialah 3: mereka ialah CaCO 3 , CaO dan CO 2 . Maklumat ini juga membolehkan kita mengira bilangan komponen bebas: n = bilangan komponen – bilangan persamaan bebas, dan dengan itu: n = 3 – 1 = 2 Kita boleh menggunakan contoh yang sama untuk mengira bilangan darjah kebebasan menggunakan persamaan untuk peraturan fasa Gibbs: s = n – f + 2 = 2 – 3 + 2 = 1 Nilai ini menunjukkan bahawa untuk mengekalkan kuantiti fasa yang stabil dalam keseimbangan sistem, kita boleh mengendalikan hanya satu pembolehubah intensif.
bilangan persamaan bebas ialah 1 – kita meneliti tindak balas tertentu yang berlaku dalam sistem. Persamaan bebas ialah sebarang sistem persamaan kimia di mana mustahil untuk mendapatkan mana-mana daripadanya dengan menggabungkan yang lain. Manakala bilangan komponen untuk sistem sedemikian ialah 3: mereka ialah CaCO 3 , CaO dan CO 2 . Maklumat ini juga membolehkan kita mengira bilangan komponen bebas: n = bilangan komponen – bilangan persamaan bebas, dan dengan itu: n = 3 – 1 = 2 Kita boleh menggunakan contoh yang sama untuk mengira bilangan darjah kebebasan menggunakan persamaan untuk peraturan fasa Gibbs: s = n – f + 2 = 2 – 3 + 2 = 1 Nilai ini menunjukkan bahawa untuk mengekalkan kuantiti fasa yang stabil dalam keseimbangan sistem, kita boleh mengendalikan hanya satu pembolehubah intensif. 
Sistem heterogen
Mana-mana sistem yang merangkumi lebih daripada satu fasa (jadi sistem tidak homogen) juga heterogen. Jenis fasa adalah tidak relevan; sistem heterogen mungkin pada masa yang sama mengandungi beberapa fasa pepejal dan cecair tetapi hanya satu fasa gas. Ini disebabkan oleh fakta bahawa gas bercampur dengan cara yang sempurna. Contoh menarik bagi sistem heterogen ialah granit – ia mengandungi banyak fasa pepejal, termasuk kuarza, kalium feldspar, plagioklas dan biotit. Banyak produk makanan juga boleh dipanggil heterogen, contoh sempurna ialah muesli berbilang bahan atau sos salad yang terdiri daripada lemak, rempah ratus dan bahan tambahan lain. Jenis campuran tidak homogen yang menarik ialah koloid (larutan yang konstituennya hanya boleh dibezakan dengan mikroskop). Walau bagaimanapun, dalam kebanyakan kes mereka boleh dipisahkan dengan kaedah atau alat mudah. Sebagai contoh, untuk mengasingkan campuran yang terdiri daripada air dan minyak, kita boleh menggunakan dekantasi – bahan-bahannya akan kelihatan dengan mata kasar. Kaedah lain yang boleh kami gunakan untuk mengasingkan campuran tidak homogen dengan berkesan termasuk: penapisan, pengasingan mekanikal atau sentrifugasi. Ia adalah serupa untuk campuran mineral yang berbeza dalam sifat: kuarza, mika dan feldspar boleh dipisahkan walaupun dengan tukul.
Sistem homogen
Tidak seperti sistem heterogen, sistem homogen dicirikan oleh kehadiran hanya satu fasa. Dalam kes sedemikian, kita tidak boleh membezakan juzuk dengan mata kasar. Kaedah pemisahan yang mudah juga tidak berkesan, dan hanya kaedah berdasarkan ciri fizikal yang mungkin berguna. Contoh kaedah sedemikian ialah pemisahan melalui penyulingan, yang berdasarkan takat didih terpelbagai sistem tertentu. Kaedah lain yang berkesan dalam mengasingkan campuran homogen ialah penghabluran dan kromatografi. Jenis khas sistem homogen ialah bahan tulen yang fasanya hanya mengandungi satu komponen sahaja. Contoh lain ialah semua jenis penyelesaian dan campuran homogen – walaupun terdapat hanya satu fasa, sistem mungkin termasuk banyak komponen. Oleh kerana fasa yang terdapat dalam sistem boleh menjadi cecair, pepejal atau gas, penyelesaian juga boleh mengambil bentuk sedemikian. Contoh sistem sedemikian ialah campuran cecair (cuka, air), campuran gas (udara atmosfera) dan campuran pepejal, termasuk bijih mineral dan semua jenis aloi, seperti gangsa atau loyang.
Peralihan dalam sistem
Dua jenis peralihan mungkin berlaku dalam sistem, ini ialah peralihan fasa (kadangkala dipanggil fizikal) dan peralihan kimia. Yang pertama termasuk semua peralihan yang tidak menghasilkan bahan kimia baru. Mereka juga tidak dicirikan oleh pudar komponen yang sedia ada. Walau bagaimanapun, seperti namanya, ia membawa kepada perubahan dalam struktur atau keadaan fizikal.. Ia juga mungkin fasa baru akan terbentuk manakala fasa asal akan pudar. Contoh peralihan fasa termasuk sublimasi semula dan peralihan polimorfik unsur. Peralihan kimia menunjukkan mekanisme yang sama sekali berbeza. Ini adalah tindak balas yang menghasilkan bahan baru yang menggantikan juzuk asal. Peralihan sedemikian boleh dilakukan dalam dua varian, contohnya semasa hidrolisis dalam satu atau lebih fasa serta semasa pembakaran.
Tindak balas kimia
- Tindak balas homogen berlaku apabila keseluruhan sistem, termasuk substrat dan produk, berada dalam satu fasa, contohnya:
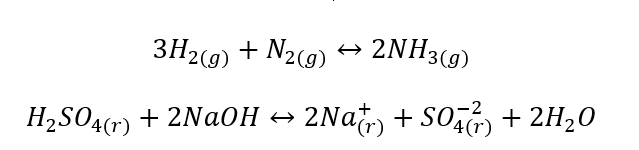
- Tindak balas heterogen ialah tindak balas sedemikian di mana sistem, termasuk substrat dan produk, sekurang-kurangnya dalam dua fasa yang berbeza. Tindak balas sedemikian sentiasa berlaku pada antara muka, contohnya: