Название "pH-буферы" относится к водным растворам, которые не изменяют своего значения pH, несмотря на введение небольшого количества щелочей или кислот, или при разбавлении. В практическом плане это смеси растворов слабых кислот и их солей вместе с сопряженными сильными основаниями (протонодаватель-протонополучатель) или, аналогично, смеси растворов слабых оснований и солей этих оснований с сильными кислотами. Основной целью использования буферных растворов является их роль в качестве агентов, позволяющих поддерживать очень стабильное значение pH. Они часто используются в широком спектре химических применений, например, при производстве красителей, во время процессов ферментации, а также для определения значения pH пищевых продуктов, косметики и фармацевтических препаратов.
Уравнение Хендерсона-Хассельбаха
Основная зависимость значения pH-буфера от pKa или pKb, используемая для кислоты или основания, соответственно, а также соотношение концентраций кислоты и сопряженного с ней основания или, аналогично, основания и сопряженной с ним кислоты, описывается уравнением Хендерсона-Хассельбаха. Он показывает зависимость между силой используемой кислоты и значением pH. Для примера реакции буфера, для приготовления которого использовано слабую кислоту, протекание следующее:
HA + H2O ↔ H3O+ + A—
В то же время корреляция между [A—], то есть молярной концентрацией сопряженного основания [моль-дм-3], [HA], которая является молярной концентрацией недиссоциированной кислоты, и pKa — отрицательным логарифмом от константы равновесия реакции диссоциации кислоты Ka, выраженная уравнением Хендерсона-Хассельбаха для такой реакции, имеет вид:
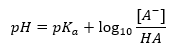
Уравнение Хендерсона-Хассельбаха для ацетатного буфера
Механизм действия буферов основан на присутствии в них ионов, обладающих способностью связывать водородные или гидроксильные ионы. При рассмотрении ацетатного буфера, который представляет собой смесь уксусной кислоты и ацетата натрия, необходимо написать реакцию диссоциации слабой уксусной кислоты и сильного электролита — ацетата натрия CH3COONa, который полностью диссоциируется на ионы:
CH3COOH ↔ H+ + CH3COO—
CH3COONa → CH3COO— + Na+
Поскольку буферный раствор представляет собой смесь этих ионов, добавление небольшого количества сильной кислоты вводит ионы [H+], которые немедленно связываются анионами CH3COO— с уксусной кислотой, которая не диссоциирует в этих условиях. Таким образом, это не приводит к снижению значения pH. Аналогично, доставка дополнительных катионов OH— путем введения в раствор сильного основания не приводит к увеличению pH. Они будут немедленно связаны ионами H+, полученными в результате диссоциации уксусной кислоты, в недиссоциированные молекулы воды.
Уравнение, описывающее константу диссоциации кислоты, имеет вид:
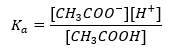
В случае диссоциации слабой уксусной кислоты общая концентрация аниона CH3COO— определяется концентрацией ионов, возникающих при диссоциации соли, которая в свою очередь равна концентрации соли (cs), т.е. ацетата натрия. Высокая концентрация этих анионов вызывает снижение концентрации катионов H+, и, следовательно, степень диссоциации кислоты снижается, чтобы значение Ka оставалось постоянно стабильным. С учетом этой зависимости можно также предположить, что количество недиссоциированных молекул CH3COOH практически равно общей концентрации уксусной кислоты (ck). Поэтому константу диссоциации можно записать в виде:
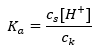
После логарифмирования получаем зависимость, приводящую к уравнению Хендерсона-Хассельбаха:
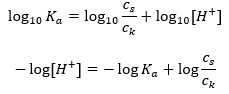
Следовательно, уравнение Хендерсона-Хассельбаха имеет вид:
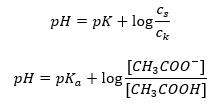
Рассматривая взаимосвязи, можем сказать, что pKa в уравнении на практике является мерой силы кислоты. Значения pKa менее 3 (-log(0.001)) характеризуют сильные кислоты, тогда как чем больше значение, тем ниже сила кислоты. Факт, вытекающий из уравнения Хендерсона-Хассельбаха — эквивалентность pH буферного раствора и pKa кислоты в момент, когда отношение концентрации недиссоциированной кислоты и концентрации аниона, образовавшегося при диссоциации кислоты, равно 1, так как log(1) равен 0.
Такие условия возникают при титровании слабой кислоты сильным основанием, когда добавляется количество основания, соответствующее половине количества, необходимого для полной нейтрализации кислоты. В таком случае степень титрования раствора составляет 50%. В зависимости от pH и объема используемого титранта значение pH в буферной зоне изменяется относительно медленно.
Пример аммонийного буфера
Другим типом буфера является аммониевый буфер, который представляет собой смесь слабого основания NH4OH и соли слабого основания с сильной кислотой NH4Cl. Однако механизм очень похож. Соль, присутствующая в смеси, претерпевает полную диссоциацию, и ее константой является уравнение:
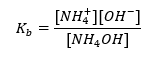
В отличие от этого, аммониевое основание практически не диссоциирует в сильном электролите, каким является NH4Cl. Поэтому предполагается, что концентрация катиона NH4+ равна концентрации соли, а концентрация недиссоциированных молекул NH4OH равна концентрации основания. Таким образом, можно составить уравнение и рассчитать pH этого буфера.
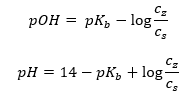
Присутствующие в аммонийном буфере ионы NH4+, Cl— и молекулы NH4OH приводят при добавлении кислоты или основания к реакциям:
NH4OH + H+ ↔ NH4+ + H2O
NH4+ + OH— ↔ NH4OH
При небольшом добавлении изменение в соотношении концентраций основания к соли и, следовательно, и изменение pH будет небольшим. В случае десятикратного изменения соотношений этих концентраций значение pH изменится на одну единицу.
Буферная емкость
Выражением буферной емкости определяется способность буферного раствора поддерживать приблизительно постоянную кислотность раствора. Точнее, это количество грамм-эквивалентов сильной кислоты или сильного основания, которое при добавлении к 1 дм3 буферного раствора изменяет его реакцию pH на одну единицу. Формула, определяющая буферную емкость (β), включает ее зависимость от количества молей сильной кислоты/основания после добавления в буферный раствор (Δn, [мл]) и изменения pH, наблюдаемого во время добавления объема сильной кислоты или основания в буферный раствор (ΔpH).
![]()
Это величина, которая сильно связана с концентрациями компонентов и возрастает с их увеличением. Наибольшее значение буферной емкости характеризует буферные растворы, pH которых равняется константе диссоциации кислоты pKa, использованной для их приготовления.
Принцип работы фосфатного буфера
Менее распространенным типом буферов являются буферы, компонентами которых являются две кислые соли. В данном случае это две кислые соли ортофосфорной кислоты (V), а именно дигидрогенфосфат (V) натрия и гидрогенортофосфат (V) натрия. В отличие от этих наиболее распространенных буферов, также основанных на принципе сопряженных кислотно-основных пар Бронстеда, распознавание природы компонентов не столь очевидно. Поскольку анионы, присутствующие в фосфатном буфере, имеют значения, характерные для кислоты Бронстеда, разницу между ними необходимо проверять более тщательно. Согласно этому принципу, ион, который является более сильной кислотой, должен иметь более высокое значение константы диссоциации.
- Для H2PO4— Ka = 6,34·10-8
- Для HPO4-2 Ka = 4,36·10-13
Оперируя такими данными, легко сделать вывод, что в данном случае именно гидроанион H2PO4-13 является слабой кислотой Бронстеда. Механизм действия буфера основан на динамическом равновесии, которое можно записать следующим уравнением:
![]()
При добавлении небольшого количества кислоты в буферный раствор система будет пытаться вызвать противодействие изменению реакции pH, в результате реакции, которая блокирует действие катионов [H+], через протонирование гидрогенаниона, согласно уравнению:
![]()
Факт, что именно анион нейтрализует буферы, добавленные в раствор, возникает из того, что он является более сильным основанием Бронстеда. Для таких систем действует эмпирическое правило: чем сильнее кислота по Бронстеду, тем слабее сопряженное основание. Если в систему, содержащую несколько оснований Бронстеда, ввести кислоту, то первым в реакцию вступит самое сильное из них. Эта зависимость является наиболее важной составляющей при рассмотрении равновесий в водных смесях буферных растворов, состоящих из смеси кислот Бронстеда и смеси слабых оснований Бронстеда. Того же принципа следует придерживаться и в обратной ситуации, при внесении раствора щелочи в фосфатный буфер. Тогда произойдет почти мгновенное улавливание анионов OH— более сильной кислотой Бронстеда, присутствующей в буфере. В данном случае это будет ион , и реакция будет протекать в соответствии с уравнением:
![]()
Известные буферы и их использование
- Кровь поддерживается на уровне 7,35 и 7,45 единиц, и ее стабильность гарантируется присутствием углекислого газа, в основном в виде растворенной двуокиси углерода и ионов HCO3-. Это слабый кислотно-солевой буфер, и внезапное добавление слишком большого количества кислоты или основания приводит к опасным для жизни состояниям. Аналогичным примером буфера является слюна, pH которой составляет около 7.
- Аммонийный буфер, ацетатный буфер, фосфатный буфер, боратный буфер, то есть последовательно:
- NH3 + NH4Cl pH = 8 – 11;
- CH3COOH + CH3COONa pH 3,5 – 6;
- K2HPO4 + KH2PO4 pH = 5,5 – 8;
- H3BO3 + Na2B4O7 pH = 7 – 9.
Все распространенные буферы используются там, где крайне важно поддерживать pH на постоянном уровне, то есть:
- в медицине, где их вводят внутривенно тяжелобольным пациентам;
- при культивировании микроорганизмов, где реакция субтрата является важным фактором;
- при работе с ферментами и белками для стабилизации среды, в которой протекают химические реакции;
- в гальванике, где они используются в гальванических ваннах для предотвращения быстрых, критических изменений pH в пространстве возле электродов;
- во время калибровки pH-метров.
