“pH tamponları” terimi, az miktarda baz veya asit katılmasına rağmen veya seyreltme sırasında pH değerini değiştirmeyen sulu çözeltileri ifade eder. Pratik anlamda, zayıf asitlerin ve bunların tuzlarının konsantre güçlü bazlarla (proton donör -proton alıcı) çözeltilerinin karışımları veya benzer şekilde, zayıf bazların ve bunların tuzlarının güçlü asitlerle çözeltilerinin karışımlarıdır. Tampon çözeltileri kullanmanın temel amacı, pH değerini oldukça kararlı bir seviyede tutmayı sağlayan ajanlar olarak hareket etmeleridir. Genellikle çok çeşitli kimyasal uygulamalarda, örneğin boya imalatında, fermantasyon işlemleri sırasında ve ayrıca gıda ürünleri, kozmetik ve farmasötiklerin pH değerini belirlemek için kullanılırlar.
Henderson-Hasselbach denklemi
Tamponun pH değerinin sırasıyla asit veya baz için kullanılan pKa veya pKb’ye ve ayrıca asit ve eşlenik bazının veya benzer şekilde baz ve eşlenik asidinin konsantrasyonlarının oranına olan temel bağımlılığı şu şekildedir: Henderson-Hasselbach denklemi ile tanımlanır. Uygulanan asidin kuvveti ile pH değeri arasındaki ilişkiyi gösterir. Zayıf bir asit kullanılarak üretilmiş bir tamponun örnek reaksiyonu için prosedür aşağıdaki gibidir: HA + H 2 O ↔ H 3 O + + A – Oysa [A –] arasındaki korelasyon, yani molar konsantrasyondur eşlenik bazın [mol ·dm -3], [HA], ayrışmamış asidin molar konsantrasyonu ve pKa – asidin denge ayrışma sabitinin negatif logaritması Böyle bir reaksiyon için Henderson-Hasselbach denklemi ile ifade edilen (Ka ), aşağıdaki forma sahiptir: 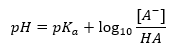
Bir asetat tamponu için Henderson-Hasselbach denklemi
Tamponların çalışma mekanizması, hidrojen veya hidroksit iyonlarını bağlayabilen iyonların varlığına dayanır. Asetik asit ve sodyum asetat karışımı olan bir asetat tamponu düşünüldüğünde, zayıf bir asetik asit ile tamamen iyonlarına ayrışan güçlü bir elektrolit olan sodyum asetat ( CH3COONa) arasındaki ayrışma reaksiyonunu not etmeliyiz: CH 3 COOH ↔ H + + CH 3 COO – CH 3COONa → CH 3COO – + Na + Tampon çözelti bu iyonların bir karışımı olduğundan, az miktarda kuvvetli asit eklenmesi [H + } } bu koşullarda ayrışmayan asetik asit oluşturmak için CH3COO – anyonları tarafından hemen bağlanan iyonlar. Sonuç olarak, bu pH değerini düşürür. Aynı şekilde çözeltiye kuvvetli bir baz katılarak ilave OH- katyonlarının sağlanması da pH seviyesini yükseltmez. Asetik asidin ayrışmamış su moleküllerine ayrışmasından kaynaklanan H + iyonları tarafından hemen bağlanırlar. Asit ayrışma sabitini tanımlayan denklem aşağıda sunulmuştur: 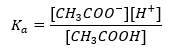 Zayıf asetik asidin ayrışması için , CH3COO – anyonunun toplam konsantrasyonu, tuzun ayrışmasından kaynaklanan iyonların konsantrasyonu ile tanımlanır, bu da tuzun konsantrasyonuyla aynıdır (c s ), bu sodyum asetattır. Bu anyonların yüksek konsantrasyonu, H + katyonlarının konsantrasyonunun düşmesine neden olur ve sonuç olarak, K a değerini sabit tutmak için asit ayrışma derecesi azalır. Bu ilişki nedeniyle, ayrışmamış CH3COOH moleküllerinin sayısının pratikte toplam asetik asit konsantrasyonuyla ( ck ) aynı olduğunu da varsayabiliriz. Bu nedenle ayrışma sabiti aşağıdaki gibi not edilebilir:
Zayıf asetik asidin ayrışması için , CH3COO – anyonunun toplam konsantrasyonu, tuzun ayrışmasından kaynaklanan iyonların konsantrasyonu ile tanımlanır, bu da tuzun konsantrasyonuyla aynıdır (c s ), bu sodyum asetattır. Bu anyonların yüksek konsantrasyonu, H + katyonlarının konsantrasyonunun düşmesine neden olur ve sonuç olarak, K a değerini sabit tutmak için asit ayrışma derecesi azalır. Bu ilişki nedeniyle, ayrışmamış CH3COOH moleküllerinin sayısının pratikte toplam asetik asit konsantrasyonuyla ( ck ) aynı olduğunu da varsayabiliriz. Bu nedenle ayrışma sabiti aşağıdaki gibi not edilebilir: 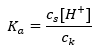 Logaritmayı aldıktan sonra, Henderson-Hasselbach denklemine götüren bir ilişki elde ederiz:
Logaritmayı aldıktan sonra, Henderson-Hasselbach denklemine götüren bir ilişki elde ederiz: 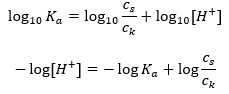 Böylece, Henderson-Hasselbach denklemi aşağıdaki forma sahiptir:
Böylece, Henderson-Hasselbach denklemi aşağıdaki forma sahiptir: 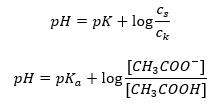 İlişkileri yazmak için , denklemdeki pKa değeri aslında asidin kuvvetinin ölçüsüdür. 3’ten (-log(0.001)) daha düşük herhangi bir pKa değeri, güçlü asitlerin karakteristiğidir, değer ne kadar yüksekse asit o kadar zayıftır. Henderson-Hasselbach denkleminden çıkan gerçek, tampon çözeltinin pH değeri ile asidin pKa değerinin, ayrışmamış asit konsantrasyonu ile ayrışma tarafından üretilen anyon konsantrasyonu arasındaki oranın aynı olduğu andaki eşdeğerliğidir. asitin oranı 1’e eşittir, log(1) 0’a eşittir. Bu tür koşullar, zayıf bir asidin güçlü bir bazla titre edilmesinin bir sonucu olarak ortaya çıkar, eğer tam nötralizasyon için gereken miktarın yarısına tekabül eden miktarda baz eklersek asidin. Daha sonra çözelti titrasyon derecesi %50’dir. Kullanılan titrantın pH’ı ile hacmi arasındaki bağımlılıkta, tampon alanındaki pH değeri nispeten yavaş değişir.
İlişkileri yazmak için , denklemdeki pKa değeri aslında asidin kuvvetinin ölçüsüdür. 3’ten (-log(0.001)) daha düşük herhangi bir pKa değeri, güçlü asitlerin karakteristiğidir, değer ne kadar yüksekse asit o kadar zayıftır. Henderson-Hasselbach denkleminden çıkan gerçek, tampon çözeltinin pH değeri ile asidin pKa değerinin, ayrışmamış asit konsantrasyonu ile ayrışma tarafından üretilen anyon konsantrasyonu arasındaki oranın aynı olduğu andaki eşdeğerliğidir. asitin oranı 1’e eşittir, log(1) 0’a eşittir. Bu tür koşullar, zayıf bir asidin güçlü bir bazla titre edilmesinin bir sonucu olarak ortaya çıkar, eğer tam nötralizasyon için gereken miktarın yarısına tekabül eden miktarda baz eklersek asidin. Daha sonra çözelti titrasyon derecesi %50’dir. Kullanılan titrantın pH’ı ile hacmi arasındaki bağımlılıkta, tampon alanındaki pH değeri nispeten yavaş değişir. 
Örnek: amonyum tamponu
Diğer bir tampon türü, zayıf bir baz ( NH4OH) ile güçlü bir asitin ( NH4CI ) karışımı olan amonyum tampondur. Ancak mekanizma çok benzer. Karışımda bulunan tuz tamamen ayrışır ve sabiti aşağıdaki denklemdir: 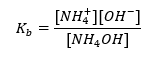 Oysa amonyum bazı, güçlü elektrolitte (NH 4 Cl) pratik olarak ayrışmaz. Bu nedenle, NH 4 + katyonunun konsantrasyonunun tuzun konsantrasyonuna eşit olduğunu, ancak ayrışmamış NH 4 OH moleküllerinin konsantrasyonunun bazın konsantrasyonuyla aynı olduğunu varsayıyoruz. Bu, denklemi formüle etmeyi ve bu tamponun pH’ını hesaplamayı mümkün kılar.
Oysa amonyum bazı, güçlü elektrolitte (NH 4 Cl) pratik olarak ayrışmaz. Bu nedenle, NH 4 + katyonunun konsantrasyonunun tuzun konsantrasyonuna eşit olduğunu, ancak ayrışmamış NH 4 OH moleküllerinin konsantrasyonunun bazın konsantrasyonuyla aynı olduğunu varsayıyoruz. Bu, denklemi formüle etmeyi ve bu tamponun pH’ını hesaplamayı mümkün kılar. 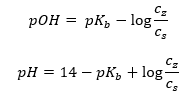 Amonyum tamponunda bulunan NH 4 + ve Cl – iyonları ve NH 4 OH molekülleri, bir asit veya baz eklediğimizde aşağıdaki reaksiyonların meydana gelmesiyle sonuçlanır: NH 4 OH + H + ↔ NH 4 + + H 2 O NH 4 + + OH – ↔ NH 4 OH İlave küçükse, baz-tuz konsantrasyon oranındaki ve dolayısıyla pH’daki değişim de küçüktür. Bu derişimlerin oranının on kat değişmesi durumunda pH değeri bir birim değişecektir.
Amonyum tamponunda bulunan NH 4 + ve Cl – iyonları ve NH 4 OH molekülleri, bir asit veya baz eklediğimizde aşağıdaki reaksiyonların meydana gelmesiyle sonuçlanır: NH 4 OH + H + ↔ NH 4 + + H 2 O NH 4 + + OH – ↔ NH 4 OH İlave küçükse, baz-tuz konsantrasyon oranındaki ve dolayısıyla pH’daki değişim de küçüktür. Bu derişimlerin oranının on kat değişmesi durumunda pH değeri bir birim değişecektir.
Tampon kapasitesi
” Tampon kapasitesi” terimi, bir tampon çözeltinin, bir çözeltinin yaklaşık olarak sabit bir asitliğini muhafaza etme kapasitesini ifade eder. Daha kesin olarak, 1 dm 3’lük bir tampon çözeltiye eklendiğinde pH değerini bir değiştiren, güçlü bir asit veya güçlü bazın gram eşdeğerlerinin sayısıdır. Tampon kapasitesini (β) tanımlayan formül, tampon çözeltisine (Δn, [ml]) eklendikten sonra güçlü bir asit/bazın mol sayısına bağlılığını ve eklenirken gözlenen pH değişimini içerir. güçlü bir asit veya bazın hacmini tampon çözeltiye (ΔpH) ekleyin. ![]() Arttıkça yükselen bileşenlerin konsantrasyonları ile güçlü bir şekilde ilişkili olan bir değerdir. Tampon kapasitesinin en yüksek değeri, pH’ı onları üretmek için kullanılan asidin ayrışma sabitine (pKa) eşit olan tampon çözeltilerini karakterize eder.
Arttıkça yükselen bileşenlerin konsantrasyonları ile güçlü bir şekilde ilişkili olan bir değerdir. Tampon kapasitesinin en yüksek değeri, pH’ı onları üretmek için kullanılan asidin ayrışma sabitine (pKa) eşit olan tampon çözeltilerini karakterize eder.
Bir fosfat tamponunun çalışma prensibi
Daha az popüler olan bir tampon türü, iki asit tuzu içeren tamponlardır. Bu durumda, ortofosforik (V) asidin iki asit tuzu, yani sodyum fosfat monobazik (V) ve sodyum fosfat dibaziktir (V). Brønsted’in eşlenik asit-baz çiftleri ilkesine dayanan en yaygın tamponların aksine, bileşenlerin doğasını belirlemek o kadar kolay değildir. Fosfat tamponunda bulunan anyonlar Brønsted asitlerinin karakteristik değerlerini gösterdiğinden, aralarındaki farkı daha dikkatli kontrol etmeliyiz. Bu prensibe göre, daha güçlü asit olan iyonun ayrışma sabiti daha yüksek olmalıdır.
- H 2 PO 4 – K a = 6.34·10 -8 için
- HPO 4 -2 K a = 4.36·10 -13 için
Elimizde böyle bir veri varsa, bu durumda zayıf Brønsted asidinin H2PO4-13 hidrojen anyonu olduğunu kolayca ifade edebiliriz. Tamponun çalışma mekanizması, aşağıdaki denklemle ifade edilebilen dinamik bir dengeye dayanmaktadır: ![]() Tampon çözeltiye az miktarda asit eklersek, sistem aşağıdakine göre hidrojen anyonunu protonlayarak [H +] katyonlarının etkisini bloke etme reaksiyonundan kaynaklanan pH değişikliklerini önlemeye çalışacaktır. denklem:
Tampon çözeltiye az miktarda asit eklersek, sistem aşağıdakine göre hidrojen anyonunu protonlayarak [H +] katyonlarının etkisini bloke etme reaksiyonundan kaynaklanan pH değişikliklerini önlemeye çalışacaktır. denklem: ![]() Çözeltiye eklenen tamponları nötralize edecek olanın anyon olması, bu anyonun daha güçlü Brønsted bazı olmasının bir sonucudur. Bu tür sistemlerde, Brønsted asidi ne kadar güçlüyse eşlenik bazının o kadar zayıf olduğunu belirten bir kural uyguluyoruz. Birkaç Brønsted bazı içeren bir sisteme bir asit eklersek, en güçlü baz ilk reaksiyona giren baz olacaktır. Bu ilişki, Brønsted asitleri ve zayıf Brønsted bazları karışımından oluşan sulu tampon çözeltilerinin karışımlarında var olan dengeleri analiz ederken en önemli bileşendir. Aynı kural, ancak ters sırada, bir fosfat tamponuna bazik bir çözelti eklediğimizde de geçerlidir. OH – anyonları, tamponda bulunan daha güçlü Brønsted asidi tarafından neredeyse anında yakalanacaktır. Bu durumda, bu iyon olacak ve reaksiyon aşağıdaki denkleme göre gerçekleşecek:
Çözeltiye eklenen tamponları nötralize edecek olanın anyon olması, bu anyonun daha güçlü Brønsted bazı olmasının bir sonucudur. Bu tür sistemlerde, Brønsted asidi ne kadar güçlüyse eşlenik bazının o kadar zayıf olduğunu belirten bir kural uyguluyoruz. Birkaç Brønsted bazı içeren bir sisteme bir asit eklersek, en güçlü baz ilk reaksiyona giren baz olacaktır. Bu ilişki, Brønsted asitleri ve zayıf Brønsted bazları karışımından oluşan sulu tampon çözeltilerinin karışımlarında var olan dengeleri analiz ederken en önemli bileşendir. Aynı kural, ancak ters sırada, bir fosfat tamponuna bazik bir çözelti eklediğimizde de geçerlidir. OH – anyonları, tamponda bulunan daha güçlü Brønsted asidi tarafından neredeyse anında yakalanacaktır. Bu durumda, bu iyon olacak ve reaksiyon aşağıdaki denkleme göre gerçekleşecek: ![]()
Bilinen tamponlar ve uygulamaları
- Kan, 7.35 ve 7.45 ünite değerlerini korur ve kararlılığı, esas olarak çözünmüş karbon dioksit ve HCO 3 formundaki karbonik asidin varlığı ile garanti edilir. aşırı miktarda asit veya baz, insan yaşamı için tehlikeli koşullara neden olur. Benzer bir tampon örneği, pH’ı yaklaşık 7 olan tükürüktür.
- Amonyum, asetat, fosfat ve borat tamponları, yani sırasıyla:
- NH3 + NH4CI pH = 8 – 11;
- CH3COOH + CH3COONa pH 3,5 – 6;
- K 2 HPO 4 + KH 2 PO 4 pH = 5,5 – 8;
- H 3 BO 3 + Na 2 B 4 O 7 pH = 7 – 9.
Tüm popüler tamponlar, pH’ı sabit bir seviyede tutmanın kritik olduğu yerlerde uygulanır, örneğin:
- kritik durumdaki hastalara intravenöz olarak uygulandıkları tıpta;
- toprağın reaksiyonunun önemli bir faktör olduğu mikrobiyal kültürlerde;
- kimyasal reaksiyonlar için ortamı stabilize etmek için enzimler ve proteinlerle çalışırken;
- Elektrot yakınındaki alanda pH’larında hızlı, kritik değişikliklerin önlenmesini sağladıklarından, elektrolitik banyolar için kullanıldıkları galvanik kaplamada;
- pH metreleri kalibre etmek için.

