Pojem „pH pufry“ se týká takových vodných roztoků, které nemění svou hodnotu pH navzdory zavedení malého množství zásad nebo kyselin nebo během ředění. Prakticky jde o směsi roztoků slabých kyselin a jejich solí s koncentrovanými silnými bázemi (protondonor – protonakceptor) nebo obdobně směsi roztoků slabých bází a jejich solí se silnými kyselinami. Hlavním cílem použití tlumivých roztoků je, že působí jako činidla, která umožňují udržení hodnoty pH na poměrně stabilní úrovni. Často se používají v široké škále chemických aplikací, například při výrobě barviv, během fermentačních procesů, stejně jako ke stanovení hodnoty pH potravinářských výrobků, kosmetiky a léčiv.
Hendersonova-Hasselbachova rovnice
Zásadní závislost hodnoty pH pufru na použitém pKa , resp. definovaný Hendersonovou-Hasselbachovou rovnicí. Ukazuje korelaci mezi silou aplikované kyseliny a hodnotou pH. Pro reakci vzorku pufru vyrobeného za použití slabé kyseliny je postup následující: HA + H 2 O ↔ H 3 O + + A – Zatímco korelace mezi [A –], to je molární koncentrace konjugované báze [mol ·dm -3], [HA], což je molární koncentrace nedisociované kyseliny a pK a – záporný logaritmus rovnovážné disociační konstanty kyseliny (Ka) , vyjádřené Henderson-Hasselbachovou rovnicí pro takovou reakci, má následující tvar: 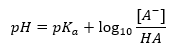
Henderson-Hasselbachova rovnice pro acetátový pufr
Funkční mechanismus pufrů je založen na přítomnosti iontů, které jsou schopny vázat vodíkové nebo hydroxidové ionty. Když uvažujeme o acetátovém pufru, což je směs kyseliny octové a octanu sodného, měli bychom si poznamenat disociační reakci mezi slabou kyselinou octovou a silným elektrolytem, octanem sodným (CH 3 COONa), který je zcela disociován na ionty: CH 3 COOH ↔ H + + CH 3 COO – CH 3 COONa → CH 3 COO – + Na + Protože tlumivý roztok je směsí těchto iontů, přidání malého množství silné kyseliny zavádí [H + } } ionty, které jsou bezprostředně vázány CH 3 COO – anionty za vzniku kyseliny octové, která je za těchto podmínek nedisociovaná. V důsledku toho se snižuje hodnota pH. Stejně tak přísun dalších OH – kationtů zavedením silné báze do roztoku nezvýší hladinu pH. Budou okamžitě vázány H + ionty pocházejícími z disociace kyseliny octové na nedisociované molekuly vody. Rovnice definující disociační konstantu kyseliny je uvedena níže: 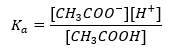 Pro disociaci slabé kyseliny octové je celková koncentrace aniontu CH 3 COO – definována koncentrací iontů pocházejících z disociace soli, která je naopak stejná jako koncentrace soli (c s ), to je octan sodný. Vysoká koncentrace těchto aniontů způsobuje pokles koncentrace kationtů H + a následně se snižuje stupeň disociace kyseliny, aby se hodnota K a udržela stabilní. Díky tomuto vztahu můžeme také předpokládat, že počet nedisociovaných molekul CH 3 COOH je prakticky totožný s celkovou koncentrací kyseliny octové (c k ). To je důvod, proč lze disociační konstantu zaznamenat následovně:
Pro disociaci slabé kyseliny octové je celková koncentrace aniontu CH 3 COO – definována koncentrací iontů pocházejících z disociace soli, která je naopak stejná jako koncentrace soli (c s ), to je octan sodný. Vysoká koncentrace těchto aniontů způsobuje pokles koncentrace kationtů H + a následně se snižuje stupeň disociace kyseliny, aby se hodnota K a udržela stabilní. Díky tomuto vztahu můžeme také předpokládat, že počet nedisociovaných molekul CH 3 COOH je prakticky totožný s celkovou koncentrací kyseliny octové (c k ). To je důvod, proč lze disociační konstantu zaznamenat následovně: 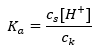 Po logaritmování získáme vztah, který vede k Henderson-Hasselbachově rovnici:
Po logaritmování získáme vztah, který vede k Henderson-Hasselbachově rovnici: 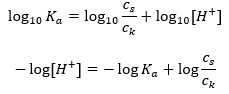 Henderson-Hasselbachova rovnice má tedy následující tvar:
Henderson-Hasselbachova rovnice má tedy následující tvar: 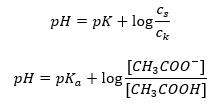 Abychom vypsali vztahy, hodnota pKa v rovnici je ve skutečnosti mírou síly kyseliny. Jakékoli hodnoty pKa nižší než 3 (-log(0,001)) jsou charakteristické pro silné kyseliny, zatímco čím vyšší hodnota, tím slabší kyselina. Skutečností vyplývající z Henderson-Hasselbachovy rovnice je ekvivalence hodnoty pH tlumivého roztoku a pKa kyseliny v okamžiku, kdy poměr koncentrace nedisociované kyseliny a koncentrace aniontu vzniklého disociací kyseliny se rovná 1, protože log(1) se rovná 0. Takové podmínky existují jako výsledek titrace slabé kyseliny silnou zásadou, pokud přidáme takové množství zásady, které odpovídá polovině množství potřebného pro úplnou neutralizaci kyseliny. Potom je stupeň titrace roztoku 50 %. V závislosti mezi pH a objemem použitého titračního činidla se hodnota pH v oblasti pufru mění poměrně pomalu.
Abychom vypsali vztahy, hodnota pKa v rovnici je ve skutečnosti mírou síly kyseliny. Jakékoli hodnoty pKa nižší než 3 (-log(0,001)) jsou charakteristické pro silné kyseliny, zatímco čím vyšší hodnota, tím slabší kyselina. Skutečností vyplývající z Henderson-Hasselbachovy rovnice je ekvivalence hodnoty pH tlumivého roztoku a pKa kyseliny v okamžiku, kdy poměr koncentrace nedisociované kyseliny a koncentrace aniontu vzniklého disociací kyseliny se rovná 1, protože log(1) se rovná 0. Takové podmínky existují jako výsledek titrace slabé kyseliny silnou zásadou, pokud přidáme takové množství zásady, které odpovídá polovině množství potřebného pro úplnou neutralizaci kyseliny. Potom je stupeň titrace roztoku 50 %. V závislosti mezi pH a objemem použitého titračního činidla se hodnota pH v oblasti pufru mění poměrně pomalu. 
Příklad: amoniový pufr
Dalším typem pufru je amoniový pufr, což je směs slabé báze (NH 4 OH) se silnou kyselinou (NH 4 Cl). Mechanismus je však velmi podobný. Sůl přítomná ve směsi podléhá úplné disociaci a její konstanta je následující rovnice: 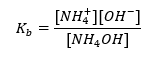 Zatímco amonná báze je v silném elektrolytu (NH 4 Cl) prakticky nedisociovaná. Z tohoto důvodu předpokládáme, že koncentrace kationtu NH 4 + je rovna koncentraci soli, ale koncentrace nedisociovaných molekul NH 4 OH je totožná s koncentrací báze. To umožňuje formulovat rovnici a vypočítat pH tohoto pufru.
Zatímco amonná báze je v silném elektrolytu (NH 4 Cl) prakticky nedisociovaná. Z tohoto důvodu předpokládáme, že koncentrace kationtu NH 4 + je rovna koncentraci soli, ale koncentrace nedisociovaných molekul NH 4 OH je totožná s koncentrací báze. To umožňuje formulovat rovnici a vypočítat pH tohoto pufru. 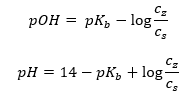 Ionty NH 4 + a Cl – a molekuly NH 4 OH přítomné v amoniovém pufru vedou k tomu, že jakmile přidáme kyselinu nebo zásadu, dojde k následujícím reakcím: NH 4 OH + H + ↔ NH 4 + + H 2 O NH 4 + + OH – ↔ NH 4 OH Pokud je přídavek malý, je malá i změna poměru koncentrace zásady a soli a tím i změna pH. V případě desetinásobné změny poměru těchto koncentrací se hodnota pH změní o jednotku.
Ionty NH 4 + a Cl – a molekuly NH 4 OH přítomné v amoniovém pufru vedou k tomu, že jakmile přidáme kyselinu nebo zásadu, dojde k následujícím reakcím: NH 4 OH + H + ↔ NH 4 + + H 2 O NH 4 + + OH – ↔ NH 4 OH Pokud je přídavek malý, je malá i změna poměru koncentrace zásady a soli a tím i změna pH. V případě desetinásobné změny poměru těchto koncentrací se hodnota pH změní o jednotku.
Kapacita vyrovnávací paměti
Termín „kapacita pufru“ se týká kapacity pufrovacího roztoku udržovat přibližně konstantní kyselost roztoku. Přesněji je to počet gramekvivalentů silné kyseliny nebo silné zásady, která po přidání do 1 dm 3 tlumivého roztoku změní hodnotu pH o jednu. Vzorec definující kapacitu pufru (β) zahrnuje její závislost na počtu molů silné kyseliny/zásady po přidání do roztoku pufru (Δn, [ml]) a na změně pH pozorované při přidávání objem silné kyseliny nebo zásady k roztoku pufru (ΔpH). ![]() Je to hodnota, která silně souvisí s koncentracemi složek, které se zvyšují, jak se zvyšují. Nejvyšší hodnota tlumivé kapacity charakterizuje tlumivé roztoky, jejichž pH se rovná disociační konstantě (pKa) kyseliny použité k jejich výrobě.
Je to hodnota, která silně souvisí s koncentracemi složek, které se zvyšují, jak se zvyšují. Nejvyšší hodnota tlumivé kapacity charakterizuje tlumivé roztoky, jejichž pH se rovná disociační konstantě (pKa) kyseliny použité k jejich výrobě.
Princip fungování fosfátového pufru
Méně oblíbeným typem pufrů jsou pufry, které obsahují dvě kyselé soli. V tomto případě se jedná o dvě kyselé soli kyseliny ortofosforečné (V), to je dihydrogenfosforečnan sodný (V) a hydrogenfosforečnan sodný (V). Na rozdíl od nejběžnějších pufrů, které jsou také založeny na Brønstedově principu konjugovaných acidobazických párů, není tak snadné určit povahu složek. Protože anionty přítomné ve fosfátovém pufru vykazují hodnoty charakteristické pro Brønstedovy kyseliny, měli bychom pečlivěji zkontrolovat rozdíl mezi nimi. Podle tohoto principu musí mít iont, který je silnější kyselinou, vyšší disociační konstantu.
- Pro H2P04 – Ka = 6,34-10-8
- Pro HPO4-2 Ka = 4,36 · 10-13
Pokud máme taková data k dispozici, můžeme snadno konstatovat, že v tomto případě je slabou Brønstedovou kyselinou vodíkový anion H 2 PO 4 -13 . Operační mechanismus vyrovnávací paměti je založen na dynamické rovnováze, kterou lze vyjádřit následující rovnicí: ![]() Pokud do roztoku pufru přidáme malá množství kyseliny, systém se pokusí zabránit změnám pH v důsledku reakce blokování účinku kationtů [H +] protonací vodíkového aniontu podle následujícího rovnice:
Pokud do roztoku pufru přidáme malá množství kyseliny, systém se pokusí zabránit změnám pH v důsledku reakce blokování účinku kationtů [H +] protonací vodíkového aniontu podle následujícího rovnice: ![]() Skutečnost, že je to anion, který neutralizuje pufry přidávané do roztoku, je důsledkem skutečnosti, že právě tento anion je silnější Brønstedova báze. V takových systémech aplikujeme pravidlo, že čím silnější je Brønstedova kyselina, tím slabší je její konjugovaná báze. Přidáme-li kyselinu do systému obsahujícího několik Brønstedových zásad, pak jako první zareaguje nejsilnější zásada. Tento vztah je nejdůležitější složkou při analýze rovnováh existujících ve směsích vodných pufrovacích roztoků sestávajících ze směsi Brønstedových kyselin a směsi slabých Brønstedových bází. Stejné pravidlo, ale v opačném pořadí, platí, když přidáváme zásaditý roztok do fosfátového pufru. OH – anionty budou téměř okamžitě zachyceny silnější Brønstedovou kyselinou přítomnou v pufru. V tomto případě to bude iont a reakce bude probíhat podle následující rovnice:
Skutečnost, že je to anion, který neutralizuje pufry přidávané do roztoku, je důsledkem skutečnosti, že právě tento anion je silnější Brønstedova báze. V takových systémech aplikujeme pravidlo, že čím silnější je Brønstedova kyselina, tím slabší je její konjugovaná báze. Přidáme-li kyselinu do systému obsahujícího několik Brønstedových zásad, pak jako první zareaguje nejsilnější zásada. Tento vztah je nejdůležitější složkou při analýze rovnováh existujících ve směsích vodných pufrovacích roztoků sestávajících ze směsi Brønstedových kyselin a směsi slabých Brønstedových bází. Stejné pravidlo, ale v opačném pořadí, platí, když přidáváme zásaditý roztok do fosfátového pufru. OH – anionty budou téměř okamžitě zachyceny silnější Brønstedovou kyselinou přítomnou v pufru. V tomto případě to bude iont a reakce bude probíhat podle následující rovnice: ![]()
Známé buffery a jejich aplikace
- Krev si udržuje hodnoty 7,35 a 7,45 jednotek a její stabilita je zaručena přítomností kyseliny uhličité, především ve formě rozpuštěného oxidu uhličitého a HCO 3- Jedná se o pufr, který je slabou kyselinou a její solí a jakýmkoliv přídavkem nadměrné množství kyselin nebo zásad způsobí stavy nebezpečné pro lidský život. Podobným příkladem pufru jsou sliny, jejichž pH je kolem 7.
- Amonné, acetátové, fosfátové a boritanové pufry, takže:
- NH 3 + NH 4 Cl pH = 8 – 11;
- CH 3 COOH + CH 3 COONa pH 3,5 – 6;
- K 2 HPO 4 + KH 2 PO 4 pH = 5,5 – 8;
- H 3 BO 3 + Na 2 B 4 O 7 pH = 7 – 9.
Všechny populární pufry se používají tam, kde je důležité udržovat pH na konstantní úrovni, takže například:
- v lékařství, kde jsou podávány intravenózně pacientům v kritickém stavu;
- v mikrobiálních kulturách, kde je důležitým faktorem reakce půdy;
- při práci s enzymy a proteiny stabilizovat prostředí pro chemické reakce;
- v galvanickém pokovování, kde se používají pro elektrolytické lázně, protože umožňují zabránit rychlým kritickým změnám jejich pH v oblasti blízko elektrody;
- pro kalibraci pH metrů.

