Il termine "tamponi pH" si riferisce a quelle soluzioni acquose che non cambiano il loro valore di pH nonostante l'introduzione di una piccola quantità di basi o acidi, o durante la diluizione. In pratica sono miscele di soluzioni di acidi deboli e loro sali con basi forti concentrate (donatore di protoni – accettore di protoni) o, analogamente, miscele di soluzioni di basi deboli e loro sali con acidi forti. L'obiettivo principale dell'utilizzo di soluzioni tampone è che agiscano come agenti che consentono di mantenere il valore del pH a un livello abbastanza stabile. Sono spesso utilizzati in un'ampia gamma di applicazioni chimiche, ad esempio nella produzione di coloranti, durante i processi di fermentazione, nonché per determinare il valore del pH di prodotti alimentari, cosmetici e farmaceutici.
L’equazione di Henderson-Hasselbach
La principale dipendenza del valore di pH del tampone dal pK a o dal pK b utilizzati rispettivamente per l’acido o la base, nonché dal rapporto tra le concentrazioni dell’acido e della sua base coniugata o, analogamente, della base e del suo acido coniugato, è definita dall’equazione di Henderson-Hasselbach. Mostra la correlazione tra la forza dell’acido applicato e il valore del pH. Per una reazione campione di un tampone prodotto utilizzando un acido debole, la procedura è la seguente: HA + H 2 O ↔ H 3 O + + A – Mentre la correlazione tra [A –], cioè la concentrazione molare della base coniugata [mol ·dm -3], [HA], essendo la concentrazione molare dell’acido non dissociato e il pK a – il logaritmo negativo della costante di dissociazione di equilibrio dell’acido (K a ), espressa con l’equazione di Henderson-Hasselbach per tale reazione, ha la seguente forma: 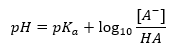
L’equazione di Henderson-Hasselbach per un tampone acetato
Il meccanismo di funzionamento dei tamponi si basa sulla presenza di ioni, che sono in grado di legare ioni idrogeno o idrossido. Quando consideriamo un tampone acetato, che è una miscela di acido acetico e acetato di sodio, dovremmo annotare la reazione di dissociazione tra un acido acetico debole e un elettrolita forte, l’acetato di sodio (CH 3 COONa), che è completamente dissociato in ioni: CH 3 COOH ↔ H + + CH 3 COO – CH 3 COONa → CH 3 COO – + Na + Poiché la soluzione tampone è una miscela di questi ioni, l’aggiunta di una piccola quantità di un acido forte introduce [H + } } ioni, che sono immediatamente legati dagli anioni CH 3 COO – per formare acido acetico che in queste condizioni non è dissociato. Di conseguenza, questo riduce il valore del pH. Allo stesso modo, l’apporto di cationi OH aggiuntivi mediante l’introduzione di una base forte nella soluzione non aumenterà il livello di pH. Saranno immediatamente legati dagli ioni H + originati dalla dissociazione dell’acido acetico in molecole d’acqua non dissociate. L’equazione che definisce la costante di dissociazione acida è presentata di seguito: 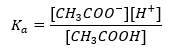 Per la dissociazione dell’acido acetico debole, la concentrazione totale dell’anione CH 3 COO – è definita dalla concentrazione di ioni originati dalla dissociazione del sale, che a sua volta è uguale alla concentrazione del sale (c s ), cioè acetato di sodio. Un’elevata concentrazione di questi anioni fa diminuire la concentrazione dei cationi H + e, di conseguenza, il grado di dissociazione acida si riduce per mantenere stabile il valore di K a . Grazie a questa relazione, possiamo anche supporre che il numero di molecole di CH 3 COOH non dissociate sia praticamente identico alla concentrazione totale di acido acetico (c k ). Questo è il motivo per cui la costante di dissociazione può essere annotata come segue:
Per la dissociazione dell’acido acetico debole, la concentrazione totale dell’anione CH 3 COO – è definita dalla concentrazione di ioni originati dalla dissociazione del sale, che a sua volta è uguale alla concentrazione del sale (c s ), cioè acetato di sodio. Un’elevata concentrazione di questi anioni fa diminuire la concentrazione dei cationi H + e, di conseguenza, il grado di dissociazione acida si riduce per mantenere stabile il valore di K a . Grazie a questa relazione, possiamo anche supporre che il numero di molecole di CH 3 COOH non dissociate sia praticamente identico alla concentrazione totale di acido acetico (c k ). Questo è il motivo per cui la costante di dissociazione può essere annotata come segue: 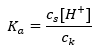 Preso il logaritmo, otteniamo una relazione che porta all’equazione di Henderson-Hasselbach:
Preso il logaritmo, otteniamo una relazione che porta all’equazione di Henderson-Hasselbach: 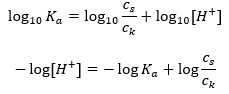 Pertanto, l’equazione di Henderson-Hasselbach ha la seguente forma:
Pertanto, l’equazione di Henderson-Hasselbach ha la seguente forma: 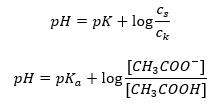 Per scrivere le relazioni, il pK un valore nell’equazione è infatti la misura della forza dell’acido. Qualsiasi valore di pK a inferiore a 3 (-log(0.001)) è caratteristico degli acidi forti, mentre maggiore è il valore, più debole è l’acido. Il fatto risultante dall’equazione di Henderson-Hasselbach è l’equivalenza del valore di pH della soluzione tampone e del pK a dell’acido nel momento in cui il rapporto tra la concentrazione dell’acido non dissociato e la concentrazione dell’anione prodotto dalla dissociazione dell’acido è uguale a 1, poiché log(1) è uguale a 0. Tali condizioni esistono come risultato della titolazione di un acido debole con una base forte, se aggiungiamo una quantità di base tale che corrisponde alla metà della quantità richiesta per la completa neutralizzazione dell’acido. Quindi il grado di titolazione della soluzione è del 50%. Nella dipendenza tra il pH e il volume del titolante utilizzato, il valore del pH nell’area del tampone cambia in modo relativamente lento.
Per scrivere le relazioni, il pK un valore nell’equazione è infatti la misura della forza dell’acido. Qualsiasi valore di pK a inferiore a 3 (-log(0.001)) è caratteristico degli acidi forti, mentre maggiore è il valore, più debole è l’acido. Il fatto risultante dall’equazione di Henderson-Hasselbach è l’equivalenza del valore di pH della soluzione tampone e del pK a dell’acido nel momento in cui il rapporto tra la concentrazione dell’acido non dissociato e la concentrazione dell’anione prodotto dalla dissociazione dell’acido è uguale a 1, poiché log(1) è uguale a 0. Tali condizioni esistono come risultato della titolazione di un acido debole con una base forte, se aggiungiamo una quantità di base tale che corrisponde alla metà della quantità richiesta per la completa neutralizzazione dell’acido. Quindi il grado di titolazione della soluzione è del 50%. Nella dipendenza tra il pH e il volume del titolante utilizzato, il valore del pH nell’area del tampone cambia in modo relativamente lento. 
Esempio: tampone ammonico
Un altro tipo di tampone è il tampone ammonico, che è una miscela di una base debole (NH 4 OH) con un acido forte (NH 4 Cl). Tuttavia, il meccanismo è molto simile. Il sale presente nella miscela subisce una completa dissociazione e la sua costante è la seguente equazione: 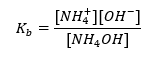 Mentre la base di ammonio è praticamente non dissociata nell’elettrolita forte (NH 4 Cl). Per questo motivo assumiamo che la concentrazione del catione NH 4 + sia uguale alla concentrazione del sale, ma la concentrazione delle molecole NH 4 OH non dissociate sia identica alla concentrazione della base. Ciò rende possibile formulare l’equazione e calcolare il pH di quel tampone.
Mentre la base di ammonio è praticamente non dissociata nell’elettrolita forte (NH 4 Cl). Per questo motivo assumiamo che la concentrazione del catione NH 4 + sia uguale alla concentrazione del sale, ma la concentrazione delle molecole NH 4 OH non dissociate sia identica alla concentrazione della base. Ciò rende possibile formulare l’equazione e calcolare il pH di quel tampone. 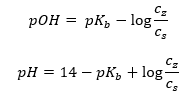 Gli ioni NH 4 + e Cl – e le molecole NH 4 OH presenti nel tampone di ammonio fanno sì che, una volta aggiunto un acido o una base, si verifichino le seguenti reazioni: NH 4 OH + H + ↔ NH 4 + + H 2 O NH 4 + + OH – ↔ NH 4 OH Se l’aggiunta è piccola, anche la variazione del rapporto di concentrazione base-sale, e quindi la variazione del pH, è piccola. In caso di decuplicazione del rapporto tra queste concentrazioni, il valore del pH cambierà di un’unità.
Gli ioni NH 4 + e Cl – e le molecole NH 4 OH presenti nel tampone di ammonio fanno sì che, una volta aggiunto un acido o una base, si verifichino le seguenti reazioni: NH 4 OH + H + ↔ NH 4 + + H 2 O NH 4 + + OH – ↔ NH 4 OH Se l’aggiunta è piccola, anche la variazione del rapporto di concentrazione base-sale, e quindi la variazione del pH, è piccola. In caso di decuplicazione del rapporto tra queste concentrazioni, il valore del pH cambierà di un’unità.
Capacità tampone
Il termine” capacità tampone” si riferisce alla capacità di una soluzione tampone di mantenere un’acidità approssimativamente costante di una soluzione. Più precisamente, è il numero di grammi equivalenti di un acido forte o di una base forte che, aggiunto a 1 dm 3 di una soluzione tampone, cambia di uno il suo valore di pH. La formula che definisce la capacità tampone (β) include la sua dipendenza dal numero di moli di un acido/base forte dopo l’aggiunta alla soluzione tampone (Δn, [ml]) e la variazione del pH osservata durante l’aggiunta del volume di un acido o di una base forte alla soluzione tampone (ΔpH). ![]() È un valore che è fortemente legato alle concentrazioni degli ingredienti, che sale man mano che aumentano. Il valore più alto della capacità tampone caratterizza le soluzioni tampone il cui pH è uguale alla costante di dissociazione (pK a ) dell’acido utilizzato per produrle.
È un valore che è fortemente legato alle concentrazioni degli ingredienti, che sale man mano che aumentano. Il valore più alto della capacità tampone caratterizza le soluzioni tampone il cui pH è uguale alla costante di dissociazione (pK a ) dell’acido utilizzato per produrle.
Principio di funzionamento di un tampone fosfato
Un tipo meno popolare di tamponi sono quelli che contengono due sali acidi. In questo caso si tratta di due sali acidi dell’acido ortofosforico (V), cioè fosfato sodico monobasico (V) e fosfato sodico bibasico (V). A differenza dei tamponi più comuni, anch’essi basati sul principio di Brønsted delle coppie coniugate acido-base, la natura degli ingredienti non è così facile da determinare. Poiché gli anioni presenti nel tampone fosfato mostrano valori caratteristici degli acidi di Brønsted, dovremmo controllare più attentamente la differenza tra loro. Secondo tale principio, lo ione essendo l’acido più forte deve avere una costante di dissociazione maggiore.
- Per H 2 PO 4 – K a = 6,34·10 -8
- Per HPO 4 -2 K a = 4.36·10 -13
Se disponiamo di tali dati, possiamo facilmente affermare che in questo caso è l’anione idrogeno H 2 PO 4 -13 ad essere l’acido debole di Brønsted. Il meccanismo di funzionamento del buffer si basa su un equilibrio dinamico che può essere espresso dalla seguente equazione: ![]() Se aggiungiamo piccole quantità di acido alla soluzione tampone, il sistema cercherà di prevenire le variazioni di pH dovute alla reazione di blocco dell’effetto dei cationi [H +] protonando l’anione idrogeno, secondo la seguente equazione:
Se aggiungiamo piccole quantità di acido alla soluzione tampone, il sistema cercherà di prevenire le variazioni di pH dovute alla reazione di blocco dell’effetto dei cationi [H +] protonando l’anione idrogeno, secondo la seguente equazione: ![]() Il fatto che sia l’anione a neutralizzare i tamponi aggiunti alla soluzione è una conseguenza del fatto che è quell’anione la base di Brønsted più forte. In tali sistemi, applichiamo una regola che afferma che più forte è l’acido di Brønsted, più debole è la sua base coniugata. Se aggiungiamo un acido a un sistema contenente diverse basi di Brønsted, allora la base più forte sarà la prima a reagire. Questa relazione è la componente più importante quando si analizzano gli equilibri esistenti in miscele di soluzioni acquose tampone costituite da una miscela di acidi di Brønsted e una miscela di basi deboli di Brønsted. La stessa regola, ma in ordine inverso, si applica quando aggiungiamo una soluzione basica in un tampone fosfato. Gli anioni OH saranno quasi immediatamente catturati dall’acido di Brønsted più forte presente nel tampone. In questo caso, questo sarà lo ione e la reazione avverrà secondo la seguente equazione:
Il fatto che sia l’anione a neutralizzare i tamponi aggiunti alla soluzione è una conseguenza del fatto che è quell’anione la base di Brønsted più forte. In tali sistemi, applichiamo una regola che afferma che più forte è l’acido di Brønsted, più debole è la sua base coniugata. Se aggiungiamo un acido a un sistema contenente diverse basi di Brønsted, allora la base più forte sarà la prima a reagire. Questa relazione è la componente più importante quando si analizzano gli equilibri esistenti in miscele di soluzioni acquose tampone costituite da una miscela di acidi di Brønsted e una miscela di basi deboli di Brønsted. La stessa regola, ma in ordine inverso, si applica quando aggiungiamo una soluzione basica in un tampone fosfato. Gli anioni OH saranno quasi immediatamente catturati dall’acido di Brønsted più forte presente nel tampone. In questo caso, questo sarà lo ione e la reazione avverrà secondo la seguente equazione: ![]()
Buffer noti e loro applicazioni
- Il sangue mantiene i valori di 7,35 e 7,45 unità, e la sua stabilità è garantita dalla presenza di acido carbonico, principalmente sotto forma di anidride carbonica disciolta e HCO 3- È un tampone essendo un acido debole e il suo sale, e l’eventuale aggiunta di una quantità eccessiva di acidi o basi causerà condizioni pericolose per la vita umana. Un esempio simile di tampone è la saliva, il cui pH è intorno a 7.
- Tamponi ammonio, acetato, fosfato e borato, quindi rispettivamente:
- NH 3 + NH 4 Cl pH = 8 – 11;
- CH 3 COOH + CH 3 COONa pH 3,5 – 6;
- K 2 HPO 4 + KH 2 PO 4 pH = 5,5 – 8;
- H 3 BO 3 + Na 2 B 4 O 7 pH = 7 – 9.
Tutti i comuni tamponi vengono applicati dove è fondamentale mantenere il pH a un livello costante, quindi ad esempio:
- in medicina, dove vengono somministrati per via endovenosa a pazienti in condizioni critiche;
- nelle colture microbiche, dove la reazione del suolo è un fattore importante;
- nel lavorare con enzimi e proteine, per stabilizzare l’ambiente per le reazioni chimiche;
- in galvanica, dove vengono utilizzati per bagni elettrolitici, in quanto consentono di evitare variazioni rapide e critiche del loro pH nella zona prossima all’elettrodo;
- per la calibrazione dei misuratori di pH.

