Termen "pH-buffertar" avser sådana vattenlösningar som inte ändrar sitt pH-värde trots att de tillsätter en liten mängd baser eller syror, eller under utspädning. Rent praktiskt är de blandningar av lösningar av svaga syror och deras salter med koncentrerade starka baser (protondonator – protonacceptor) eller, analogt, blandningar av lösningar av svaga baser och deras salter med starka syror. Huvudmålet med att använda buffertlösningar är att de fungerar som medel som gör det möjligt att hålla pH-värdet på en ganska stabil nivå. De används ofta i ett brett spektrum av kemiska tillämpningar, till exempel vid färgtillverkning, under fermenteringsprocesser, samt för att bestämma pH-värdet för livsmedel, kosmetika och läkemedel.
Henderson-Hasselbachs ekvation
Det huvudsakliga beroendet av buffertens pH-värde på pKa eller pKb som används för syran respektive basen, liksom förhållandet mellan koncentrationerna av syran och dess konjugerade bas eller, analogt, basen och dess konjugerade syra, är definieras av Henderson-Hasselbach-ekvationen. Den visar sambandet mellan styrkan hos den applicerade syran och pH-värdet. För en provreaktion av en buffert producerad med hjälp av en svag syra, är proceduren som följer: HA + H 2 O ↔ H 3 O + + A – Medan korrelationen mellan [A –], det vill säga den molära koncentrationen av den konjugerade basen [mol ·dm -3], [HA], som är den molära koncentrationen av den icke-dissocierade syran och pK a – den negativa logaritmen för syrans jämviktsdissociationskonstant (K a ), uttryckt med Henderson-Hasselbach-ekvationen för en sådan reaktion, har följande form: 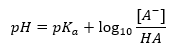
Henderson-Hasselbachs ekvation för en acetatbuffert
Driftsmekanismen för buffertar är baserad på närvaron av joner, som kan binda väte- eller hydroxidjoner. När vi överväger en acetatbuffert, som är en blandning av ättiksyra och natriumacetat, bör vi notera dissociationsreaktionen mellan en svag ättiksyra och en stark elektrolyt, natriumacetat (CH 3 COONa), som är fullständigt dissocierad till joner: CH 3 COOH ↔ H + + CH 3 COO – CH 3 COONa → CH 3 COO – + Na + Eftersom buffertlösningen är en blandning av dessa joner, introducerar tillsatsen av en liten mängd av en stark syra [H + } } joner, som omedelbart binds av CH 3 COO – anjoner för att bilda ättiksyra som är icke-dissocierad under dessa förhållanden. Följaktligen minskar detta pH-värdet. På samma sätt kommer tillförseln av ytterligare OH – katjoner genom att införa en stark bas till lösningen inte att öka pH-nivån. De kommer omedelbart att bindas av H + -joner som härrör från dissociationen av ättiksyran till icke-dissocierade vattenmolekyler. Ekvationen som definierar syradissociationskonstanten presenteras nedan: 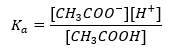 För dissociering av svag ättiksyra definieras den totala koncentrationen av CH 3 COO – anjonen av koncentrationen av joner som härrör från dissociationen av saltet, vilket i sin tur är detsamma som koncentrationen av saltet (c s ), dvs natriumacetat. En hög koncentration av dessa anjoner gör att koncentrationen av H + -katjoner minskar och följaktligen reduceras graden av syradissociation för att hålla K-värdet stabilt. På grund av detta samband kan vi också anta att antalet icke-dissocierade CH 3 COOH-molekyler är praktiskt taget identiskt med den totala koncentrationen av ättiksyra (c k ). Det är därför dissociationskonstanten kan noteras enligt följande:
För dissociering av svag ättiksyra definieras den totala koncentrationen av CH 3 COO – anjonen av koncentrationen av joner som härrör från dissociationen av saltet, vilket i sin tur är detsamma som koncentrationen av saltet (c s ), dvs natriumacetat. En hög koncentration av dessa anjoner gör att koncentrationen av H + -katjoner minskar och följaktligen reduceras graden av syradissociation för att hålla K-värdet stabilt. På grund av detta samband kan vi också anta att antalet icke-dissocierade CH 3 COOH-molekyler är praktiskt taget identiskt med den totala koncentrationen av ättiksyra (c k ). Det är därför dissociationskonstanten kan noteras enligt följande: 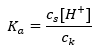 Efter att ha tagit logaritmen får vi ett samband som leder till Henderson-Hasselbachs ekvation:
Efter att ha tagit logaritmen får vi ett samband som leder till Henderson-Hasselbachs ekvation: 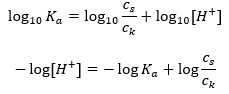 Sålunda har Henderson-Hasselbach-ekvationen följande form:
Sålunda har Henderson-Hasselbach-ekvationen följande form: 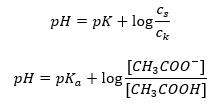 För att skriva ut sambanden är pK a -värdet i ekvationen i själva verket måttet på syrans styrka. Alla pK a -värden lägre än 3 (-log(0,001)) är karakteristiska för starka syror, medan ju högre värde desto svagare är syran. Det faktum som resulterar från Henderson-Hasselbach-ekvationen är ekvivalensen av buffertlösningens pH-värde och pKa för syran i det ögonblick då förhållandet mellan koncentrationen av den icke-dissocierade syran och koncentrationen av anjonen som produceras av dissociationen av syran är lika med 1, eftersom log(1) är lika med 0. Sådana förhållanden föreligger som ett resultat av titrering av en svag syra med en stark bas, om vi tillsätter en sådan mängd av basen som motsvarar hälften av den mängd som krävs för fullständig neutralisering av syran. Då är lösningens titreringsgrad 50 %. I beroendet mellan pH och volymen av titranten som används ändras pH-värdet i buffertområdet relativt långsamt.
För att skriva ut sambanden är pK a -värdet i ekvationen i själva verket måttet på syrans styrka. Alla pK a -värden lägre än 3 (-log(0,001)) är karakteristiska för starka syror, medan ju högre värde desto svagare är syran. Det faktum som resulterar från Henderson-Hasselbach-ekvationen är ekvivalensen av buffertlösningens pH-värde och pKa för syran i det ögonblick då förhållandet mellan koncentrationen av den icke-dissocierade syran och koncentrationen av anjonen som produceras av dissociationen av syran är lika med 1, eftersom log(1) är lika med 0. Sådana förhållanden föreligger som ett resultat av titrering av en svag syra med en stark bas, om vi tillsätter en sådan mängd av basen som motsvarar hälften av den mängd som krävs för fullständig neutralisering av syran. Då är lösningens titreringsgrad 50 %. I beroendet mellan pH och volymen av titranten som används ändras pH-värdet i buffertområdet relativt långsamt. 
Exempel: ammoniumbuffert
En annan typ av buffert är ammoniumbufferten, som är en blandning av en svag bas (NH 4 OH) med en stark syra (NH 4 Cl). Mekanismen är dock väldigt lik. Saltet som finns i blandningen genomgår fullständig dissociation, och dess konstant är följande ekvation: 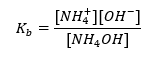 Medan ammoniumbasen är praktiskt taget icke-dissocierad i den starka elektrolyten ( NH4Cl ). Av denna anledning antar vi att koncentrationen av NH 4 + katjonen är lika med koncentrationen av saltet, men koncentrationen av icke-dissocierade NH 4 OH-molekyler är identisk med koncentrationen av basen. Detta gör det möjligt att formulera ekvationen och beräkna pH för den bufferten.
Medan ammoniumbasen är praktiskt taget icke-dissocierad i den starka elektrolyten ( NH4Cl ). Av denna anledning antar vi att koncentrationen av NH 4 + katjonen är lika med koncentrationen av saltet, men koncentrationen av icke-dissocierade NH 4 OH-molekyler är identisk med koncentrationen av basen. Detta gör det möjligt att formulera ekvationen och beräkna pH för den bufferten. 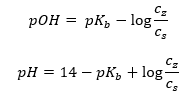 NH 4 + och Cl –jonerna och NH 4 OH-molekylerna som finns i ammoniumbufferten resulterar i att när vi väl tillsätter en syra eller bas inträffar följande reaktioner: NH 4 OH + H + ↔ NH 4 + + H 2 O NH 4 + + OH – ↔ NH 4 OH Om tillsatsen är liten är också förändringen i förhållandet bas–saltkoncentration, och därmed förändringen av pH, liten. Vid en tiofaldig förändring av förhållandet mellan dessa koncentrationer kommer pH-värdet att ändras med en enhet.
NH 4 + och Cl –jonerna och NH 4 OH-molekylerna som finns i ammoniumbufferten resulterar i att när vi väl tillsätter en syra eller bas inträffar följande reaktioner: NH 4 OH + H + ↔ NH 4 + + H 2 O NH 4 + + OH – ↔ NH 4 OH Om tillsatsen är liten är också förändringen i förhållandet bas–saltkoncentration, och därmed förändringen av pH, liten. Vid en tiofaldig förändring av förhållandet mellan dessa koncentrationer kommer pH-värdet att ändras med en enhet.
Buffertkapacitet
Termen” buffertkapacitet” avser kapaciteten hos en buffertlösning att upprätthålla en ungefärligen konstant surhet i en lösning. Närmare bestämt är det antalet gramekvivalenter av en stark syra eller stark bas som, när den läggs till 1 dm 3 av en buffertlösning, ändrar sitt pH-värde med ett. Formeln som definierar buffertkapaciteten (β) inkluderar dess beroende av antalet mol av en stark syra/bas efter tillsats till buffertlösningen (Δn, [ml]) och förändringen i pH som observeras vid tillsats av volymen av en stark syra eller bas till buffertlösningen (ΔpH). ![]() Det är ett värde som starkt relaterar till koncentrationerna av ingredienserna, som stiger när de ökar. Det högsta värdet på buffertkapaciteten kännetecknar buffertlösningarna vars pH är lika med dissociationskonstanten (pKa) för syran som används för att producera dem.
Det är ett värde som starkt relaterar till koncentrationerna av ingredienserna, som stiger när de ökar. Det högsta värdet på buffertkapaciteten kännetecknar buffertlösningarna vars pH är lika med dissociationskonstanten (pKa) för syran som används för att producera dem.
Funktionsprincip för en fosfatbuffert
En mindre populär typ av buffertar är de buffertar som innehåller två sura salter. I det här fallet är de två sura salter av ortofosforsyra (V), det vill säga monobasiskt natriumfosfat (V) och tvåbasiskt natriumfosfat (V). Till skillnad från de vanligaste buffertarna, som också är baserade på Brønsted-principen med konjugat syra-baspar, är ingrediensernas natur inte så lätt att avgöra. Eftersom anjonerna som finns i fosfatbufferten visar värden som är karakteristiska för Brønsted-syror, bör vi kontrollera skillnaden mellan dem mer noggrant. Enligt den principen måste jonen som är den starkare syran ha en högre dissociationskonstant.
- För H2P04 – Ka = 6,34 · 10-8
- För HPO4-2K a = 4,36 · 10-13
Om vi har sådana data tillgängliga kan vi enkelt konstatera att i detta fall är det H 2 PO 4 -13 väteanjonen som är den svaga Brønsted-syran. Buffertens funktionsmekanism är baserad på en dynamisk jämvikt som kan uttryckas med följande ekvation: ![]() Om vi tillsätter små mängder syra till buffertlösningen kommer systemet att försöka förhindra förändringar i pH på grund av reaktionen att blockera effekten av [H +] katjoner genom att protonera väteanjonen, enligt följande ekvation:
Om vi tillsätter små mängder syra till buffertlösningen kommer systemet att försöka förhindra förändringar i pH på grund av reaktionen att blockera effekten av [H +] katjoner genom att protonera väteanjonen, enligt följande ekvation: ![]() Det faktum att det är anjonen som kommer att neutralisera buffertarna som tillsätts lösningen är en konsekvens av att det är den anjonen som är den starkare Brønsted-basen. I sådana system tillämpar vi en regel som säger att ju starkare Brønsted-syran är, desto svagare är dess konjugerade bas. Om vi lägger till en syra till ett system som innehåller flera Brønsted-baser, kommer den starkaste basen att vara den första som reagerar. Detta förhållande är den viktigaste komponenten när man analyserar jämvikten som finns i blandningar av vattenhaltiga buffertlösningar bestående av en blandning av Brønsted-syror och en blandning av svaga Brønsted-baser. Samma regel, men i omvänd ordning, gäller när vi tillsätter en basisk lösning i en fosfatbuffert. OH – anjonerna kommer nästan omedelbart att fångas av den starkare Brønsted-syran som finns i bufferten. I det här fallet kommer detta att vara jonen, och reaktionen kommer att ske enligt följande ekvation:
Det faktum att det är anjonen som kommer att neutralisera buffertarna som tillsätts lösningen är en konsekvens av att det är den anjonen som är den starkare Brønsted-basen. I sådana system tillämpar vi en regel som säger att ju starkare Brønsted-syran är, desto svagare är dess konjugerade bas. Om vi lägger till en syra till ett system som innehåller flera Brønsted-baser, kommer den starkaste basen att vara den första som reagerar. Detta förhållande är den viktigaste komponenten när man analyserar jämvikten som finns i blandningar av vattenhaltiga buffertlösningar bestående av en blandning av Brønsted-syror och en blandning av svaga Brønsted-baser. Samma regel, men i omvänd ordning, gäller när vi tillsätter en basisk lösning i en fosfatbuffert. OH – anjonerna kommer nästan omedelbart att fångas av den starkare Brønsted-syran som finns i bufferten. I det här fallet kommer detta att vara jonen, och reaktionen kommer att ske enligt följande ekvation: ![]()
Kända buffertar och deras tillämpningar
- Blodet bibehåller värdena på 7,35 och 7,45 enheter, och dess stabilitet garanteras av närvaron av kolsyra, främst i form av löst koldioxid och HCO 3- Det är en buffert som är en svag syra och dess salt, och eventuell tillsats av en alltför stor mängd syror eller baser kommer att orsaka förhållanden som är farliga för människors liv. Ett liknande exempel på en buffert är saliv, vars pH är runt 7.
- Ammonium-, acetat-, fosfat- och boratbuffertar, så respektive:
- NH3 + NH4Cl pH = 8 – 11;
- CH 3 COOH + CH 3 COONa pH 3,5 – 6;
- K 2 HPO 4 + KH 2 PO 4 pH = 5,5 – 8;
- H 3 BO 3 + Na 2 B 4 O 7 pH = 7 – 9.
Alla populära buffertar appliceras där det är viktigt att hålla pH på en konstant nivå, till exempel:
- inom medicin, där de administreras intravenöst till patienter i kritiskt tillstånd;
- i mikrobiella kulturer, där jordens reaktion är en viktig faktor;
- att arbeta med enzymer och proteiner för att stabilisera miljön för kemiska reaktioner;
- vid elektroplätering, där de används för elektrolytiska bad, eftersom de möjliggör förhindrande av snabba, kritiska förändringar i deras pH i området nära elektroden;
- för kalibrering av pH-mätare.

