Nazwa bufory pH odnosi się do roztworów wodnych, które mimo wprowadzania niewielkich ilości zasad lub kwasów, lub podczas rozcieńczania, nie zmieniają swojej wartości pH. Pod względem praktycznym, są to mieszaniny roztworów słabych kwasów i ich soli wraz ze sprzężonymi mocnymi zasadami (protonodawca-protonobiorca) lub analogicznie, mieszaniny roztworów słabych zasad i soli tych zasad z mocnymi kwasami. Głównym celem w zastosowaniu roztworów buforowych jest ich rola jako czynniki, które umożliwiają utrzymanie wartości pH na bardzo stabilnym poziomie. Często wykorzystywane w szerokim zakresie zastosowań chemicznych, na przykład podczas produkcji barwników, w trakcie procesów fermentacyjnych, a także w celu określenia wartości pH produktów spożywczych, kosmetyków oraz wyrobów farmaceutycznych.
Równanie Hendersona-Hasselbacha
Podstawową zależność wartości pH buforu od pKa lub pKb użytej odpowiednio dla kwasu lub zasady, a także stosunek stężeń kwasu i sprzężonej z nim zasady lub analogicznie zasady oraz sprzężonego z nią kwasu, opisuje równanie Hendersona-Hasselbacha. Ukazuje ono korelację pomiędzy siłą użytego kwasu oraz wartością pH. Dla przykładowej reakcji buforu, do sporządzenia którego użyto słabego kwasu, przebieg jest następujący:
HA + H2O ↔ H3O+ + A–
Natomiast korelacja pomiędzy [A–], czyli stężeniem molowym sprzężonej zasady [mol·dm-3], [HA], będącym stężeniem molowym niezdysocjowanego kwasu oraz pKa – ujemnym logarytmie ze stałej równowagi reakcji dysocjacji kwasu Ka, wyrażona równaniem Hedndersona-Hasselbacha dla takiej reakcji ma postać:
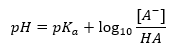
Równanie Hendersona-Hasselbacha dla buforu octanowego
Mechanizm działania buforów oparty jest na obecności w nich jonów, które mają zdolność do wiązania jonów wodorowych lub wodorotlenowych. Rozważając bufor octanowy, który jest mieszaniną kwasu octowego oraz octanu sodu, należy napisać reakcję dysocjacji słabego kwasu octowego oraz mocnego elektrolitu – octanu sodu CH3COONa, który jest całkowicie zdysocjowany na jony:
CH3COOH ↔ H+ + CH3COO–
CH3COONa → CH3COO– + Na+
Ze względu na to, iż roztwór buforowy stanowi mieszaninę tych jonów, dodatek niewielkiej ilości mocnego kwasu wprowadza jony [H+], które natychmiast są wiązane przez aniony CH3COO– na niezdysocjowany w tych warunkach kwas octowy. Nie skutkuje to więc obniżeniem wartości pH. W ten sam sposób, dostarczanie dodatkowych kationów OH– poprzez wprowadzenie do roztworu mocnej zasady, nie spowoduje podwyższenia pH. Zostaną one natychmiast związane przez jony H+, pochodzące z dysocjacji kwasu octowego, w niezdysocjowane cząsteczki wody.
Równanie opisujące stałą dysocjacji kwasu to:
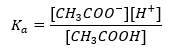
W przypadku dysocjacji słabego kwasu octowego, całkowite stężenie anionu CH3COO– jest określone poprzez stężenie jonów pochodzących z dysocjacji soli, które z kolei jest takie samo jak stężenie soli (cs), czyli octanu sodu. Wysokie stężenie tych anionów powoduje obniżanie się stężenia kationów H+, a co za tym idzie stopień dysocjacji kwasu obniża się, aby wartość Ka była ciągle stabilna. Dzięki tej zależności, można również przyjąć, że ilość niezdysocjowanych cząsteczek CH3COOH jest praktycznie równa całkowitemu stężeniu kwasu octowego (ck). Dlatego możliwe jest zapisanie stałej dysocjacji w postaci:
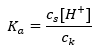
Po zlogarytmowaniu otrzymujemy zależność prowadzącą do równania Hendersona-Hasselbacha:
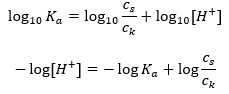
Stąd, równanie Hendersona-Hasselbacha ma postać:
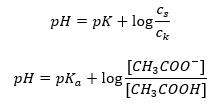
Rozpisując zależności, pKa w równaniu jest w praktyce miarą mocy kwasu. Wartości pKa mniejsze od 3 (-log(0,001)) charakteryzują kwasy o dużej mocy, natomiast im większa jest ta wartość tym mniejsza moc kwasu. Fakt, wynikający z równania Hendersona-Hasselbacha to równowartość pH roztworu buforowego oraz pKa kwasu w momencie, gdy stosunek stężenia niezdysocjowanego kwasu oraz stężenia anionu powstałego w wyniku dysocjacji kwasu, jest równy 1, gdyż log(1) wynosi 0.
Takie warunki zachodzą w wyniku miareczkowania słabego kwasu mocną zasadą, w przypadku dodania takiej ilości zasady, która odpowiada połowie ilości potrzebnej do całkowitego zobojętnienia kwasu. Stopień zmiareczkowania roztworu wynosi wtedy 50%. W zależności pomiędzy pH a objętością użytego titranta, wartość pH w obszarze buforowym zmienia się stosunkowo wolno.
Przykład buforu amonowego
Innym typem buforu jest bufor amonowy, będący mieszaniną słabej zasady NH4OH i soli słabej zasady z mocnym kwasem NH4Cl. Mechanizm jest jednak bardzo zbliżony. Obecna w mieszaninie sól ulega całkowitej dysocjacji, a jego stała to równanie:
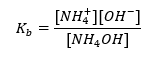
Natomiast zasada amonowa jest praktycznie niezdysocjowana w mocnym elektrolicie, jakim jest NH4Cl. Z tego względu przyjmuje się, że stężenie kationu NH4+ jest równe stężeniu soli, ale stężenie niezdysocjowanych cząsteczek NH4OH jest takie samo, jak stężenie zasady. Dzięki temu, możliwe jest ułożenie równania oraz obliczenie pH tego buforu.
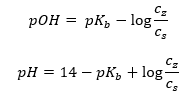
Obecne w buforze amonowym jony NH4+, Cl– oraz cząsteczki NH4OH skutkują tym, że po dodaniu kwasu lub zasady zachodzą reakcje:
NH4OH + H+ ↔ NH4+ + H2O
NH4+ + OH– ↔ NH4OH
Jeżeli dodatek jest niewielki, zmiana stosunku stężenia zasady do soli, a więc i zmiana pH jest niewielka. W przypadku dziesięciokrotnej zmiany stosunku tych stężeń, nastąpi zmiana wartości pH o jedną jednostkę.
Pojemność buforowa
Wyrażeniem pojemności buforowej, określana jest zdolność roztworu buforowego do utrzymania w przybliżeniu stałej kwasowości roztworu. Dokładniej, jest to liczba gramorównoważników mocnego kwasu lub mocnej zasady, która po dodaniu do 1dm3 roztworu buforowego zmienia jego odczyn pH o jedną jednostkę. Wzór, określający pojemność buforową (β) zawiera jej zależność od ilości moli mocnego kwasu/zasady po dodaniu do roztworu buforowego (Δn, [ml]) oraz zmiany pH obserwowanej w trakcie dodawania objętości mocnego kwasu lub zasady do roztworu buforowego (ΔpH).
![]()
Jest to wartość silnie związana ze stężeniami składników, która wzrasta wraz z ich zwiększaniem. Największa wartość pojemności buforowej charakteryzuje roztwory buforowe, których pH jest równe stałej dysocjacji kwasu pKa, użytego do ich sporządzenia.
Zasada działania buforu fosforanowego
Mniej popularnym typem buforów są te, którego składnikami są dwie wodorosole. W tym przypadku są to dwie wodorosole kwasu ortofosforowego (V), czyli diwodorofosforan (V) sodu oraz wodoroortofosforan (V) sodu. W przeciwieństwie do tych najbardziej powszechnych buforów, również opartych na zasadzie sprzężonych par kwas-zasada Brønsteda, rozpoznanie charakteru składników nie jest tak oczywiste. Ponieważ obecne w buforze fosforanowym aniony posiadają charakterystyczne dla kwasów Brønsteda wartości, należy dokładniej sprawdzić różnicę między nimi. Według tej zasady, jon będący mocniejszym kwasem musi posiadać większą wartość stałej dysocjacji.
- Dla H2PO4– Ka = 6,34·10-8
- Dla HPO4-2 Ka = 4,36·10-13
Operując takimi danymi, łatwo można stwierdzić, że w tym wypadku to wodoroanion H2PO4-13 jest słabym kwasem Brønsteda. Mechanizm działania buforu oparty jest o równowagę dynamiczną, którą można zapisać następującym równaniem:
![]()
W przypadku dodawania do roztworu buforowego małych ilości kwasu, układ będzie starał się doprowadzić do przeciwdziałania zmianom odczynu pH, w wyniku reakcji blokowania działania kationów [H+], poprzez protonowanie wodoroanionu, według równania:
![]()
Fakt, iż to anion będzie zobojętniał dodawane do roztworu bufory, wynika z tego, że to on jest mocniejszą zasadą Brønsteda. W przypadku takich układów, stosowana jest reguła mówiąca o tym, że im mocniejszy jest kwas Brønsteda, tym słabsza sprzężona z nim zasada. Jeżeli do układu zawierającego kilka zasad Brønsteda wprowadzony zostanie kwas, to wówczas w pierwszej kolejności przereaguje najmocniejsza z nich. Ta zależność jak najważniejszą składową rozważania równowag w mieszaninach wodnych roztworów buforowych, składających się z mieszaniny kwasów Brønsteda oraz mieszaniny słabych zasad Brønsteda. Tą samą zasadą należy się kierować w odwrotnej sytuacji, podczas wprowadzenia do buforu fosforanowego, roztworu zasady. Nastąpi wtedy niemal natychmiastowe wyłapanie anionów OH– przez obecny w buforze, mocniejszy kwas Brønsteda. W tym wypadku będzie to jon , a reakcja przebiegnie według równania:
![]()
Znane bufory i ich zastosowanie
- Krew utrzymuje się na poziomie 7,35 i 7,45 jednostki, a jej stabilność gwarantuje obecność kwasu węglowego, głównie w postaci rozpuszczonego dwutlenku węgla oraz jonów HCO3-. Jest to bufor typu słaby kwas i jego sól, a nagłe dodatki zbyt dużych ilości kwasów lub zasad prowadzą do niebezpiecznych dla życia człowieka stanów. Podobnym przykładem buforu jest ślina, której pH wynosi około 7.
- Bufor amonowy, octanowy, fosforanowy boranowy, czyli kolejno:
- NH3 + NH4Cl pH = 8 – 11;
- CH3COOH + CH3COONa pH 3,5 – 6;
- K2HPO4 + KH2PO4 pH = 5,5 – 8;
- H3BO3 + Na2B4O7 pH = 7 – 9.
Wszystkie popularne bufory znajdują zastosowanie wszędzie tam, gdzie krytyczne jest utrzymanie poziomu pH na stałej wartości, czyli między innymi:
- w medycynie, gdzie podawane są dożylnie pacjentom w stanie krytycznym;
- podczas prowadzenia hodowli mikroorganizmów, gdzie odczyn podłoża jest ważnym czynnikiem;
- w pracy z enzymami i białkami w celu stabilizacji środowiska, w którym przebiegają reakcje chemiczne;
- w galwanotechnice mają zastosowanie w kąpielach galwanicznych, gdyż pozwalają na zapobieganie szybkim, krytycznym zmianom ich pH w przestrzeni przyelektrodowej;
- podczas kalibracji pH-metrów.
