คำว่า “บัฟเฟอร์ pH” อ้างอิงถึงสารละลายที่เป็นน้ำดังกล่าวซึ่งไม่เปลี่ยนค่า pH ของพวกมันแม้ว่าจะใส่เบสหรือกรดในปริมาณเล็กน้อย หรือระหว่างการเจือจาง ในทางปฏิบัติ พวกมันคือของผสมของสารละลายของกรดอ่อนและเกลือของพวกมันกับเบสแก่เข้มข้น (ผู้ให้โปรตอน – ตัวรับโปรตอน) หรือในทำนองเดียวกัน ของผสมของสารละลายของเบสอ่อนและเกลือของพวกมันกับกรดแก่ เป้าหมายหลักของการใช้สารละลายบัฟเฟอร์คือทำหน้าที่เป็นสารที่ช่วยรักษาค่า pH ให้อยู่ในระดับคงที่ มักใช้ในอุตสาหกรรมเคมีหลายประเภท เช่น ในการผลิตสีย้อม ในระหว่างกระบวนการหมัก ตลอดจนใช้กำหนดค่า pH ของผลิตภัณฑ์อาหาร เครื่องสำอาง และยา
สมการเฮนเดอร์สัน-ฮัสเซิลบาค
การพึ่งพาหลักของค่า pH ของบัฟเฟอร์บน pK a หรือ pK b ที่ใช้สำหรับกรดหรือเบส ตามลำดับ ตลอดจนอัตราส่วนของความเข้มข้นของกรดและเบสที่ควบแน่นของกรด หรือในทำนองเดียวกัน เบสและกรดที่ควบแน่นของกรดคือ กำหนดโดยสมการ Henderson-Hasselbach แสดงความสัมพันธ์ระหว่างความแรงของกรดที่ใช้กับค่า pH สำหรับตัวอย่างปฏิกิริยาของบัฟเฟอร์ที่เกิดขึ้นโดยใช้กรดอ่อน มีขั้นตอนดังต่อไปนี้: HA + H 2 O ↔ H 3 O + + A – ในขณะที่ความสัมพันธ์ระหว่าง [A –] นั่นคือความเข้มข้นของโมลาร์ ของคอนจูเกตเบส [mol ·dm -3], [HA] ซึ่งเป็นความเข้มข้นโมลาร์ของกรดที่ไม่แยกตัวและ pK a – ลอการิทึมเชิงลบของค่าคงที่การแยกตัวออกจากสมดุลของกรด (K a ) แสดงด้วยสมการ Henderson-Hasselbach สำหรับปฏิกิริยาดังกล่าว มีรูปแบบดังต่อไปนี้: 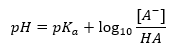
สมการ Henderson-Hasselbach สำหรับอะซิเตตบัฟเฟอร์
กลไกการทำงานของบัฟเฟอร์ขึ้นอยู่กับการมีอยู่ของไอออน ซึ่งสามารถจับกับไฮโดรเจนหรือไฮดรอกไซด์ไอออนได้ เมื่อพิจารณาบัฟเฟอร์อะซิเตตซึ่งเป็นส่วนผสมของกรดอะซิติกและโซเดียมอะซิเตต เราควรสังเกตปฏิกิริยาการแยกตัวระหว่างกรดอะซิติกที่อ่อนกับอิเล็กโทรไลต์ที่แรง โซเดียมอะซิเตต (CH 3 COONa) ซึ่งแตกตัวเป็นไอออนอย่างสมบูรณ์: C H 3 COOH ↔ H + + CH 3 COO – CH 3 COONa → CH 3 COO – + Na + เนื่องจากสารละลายบัฟเฟอร์เป็นส่วนผสมของไอออนเหล่านี้ การเติมกรดแก่ในปริมาณเล็กน้อยทำให้ [H + } } ไอออน ซึ่งถูกผูกมัดทันทีโดย CH 3 COO – แอนไอออนเพื่อสร้างกรดอะซิติกซึ่งไม่แยกออกจากกันในสภาวะเหล่านี้ ส่งผลให้ค่า pH ลดลง ในทำนองเดียวกัน การจัดหา OH – ไอออนบวกเพิ่มเติมโดยการใส่เบสแก่ลงในสารละลายจะไม่ทำให้ระดับ pH เพิ่มขึ้น พวกมันจะถูกจับทันทีโดย H + ไอออนที่เกิดจากการแยกตัวของกรดอะซิติกออกเป็นโมเลกุลของน้ำที่ไม่แยกตัว สมการที่กำหนดค่าคงที่การแยกตัวของกรดแสดงไว้ด้านล่าง: 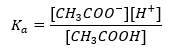 สำหรับการแตกตัวของกรดอะซิติกอ่อน ความเข้มข้นรวมของ CH 3 COO – แอนไอออนถูกกำหนดโดยความเข้มข้นของไอออนที่เกิดจากการแตกตัวของเกลือ ซึ่งจะเท่ากับความเข้มข้นของเกลือ (c s ) นั่นคือโซเดียมอะซิเตต ความเข้มข้นสูงของแอนไอออนเหล่านี้ทำให้ความเข้มข้นของไอออนบวก H + ลดลง และส่งผลให้ระดับการแยกตัวของกรดลดลงเพื่อรักษาค่า K ให้ คงที่ เนื่องจากความสัมพันธ์นี้ เราสามารถสรุปได้ว่าจำนวนของโมเลกุล CH 3 COOH ที่ไม่แยกออกจากกันนั้นเกือบจะเหมือนกับความเข้มข้นทั้งหมดของกรดอะซิติก (c k ) นี่คือสาเหตุที่สามารถบันทึกค่าคงที่การแยกตัวได้ดังนี้:
สำหรับการแตกตัวของกรดอะซิติกอ่อน ความเข้มข้นรวมของ CH 3 COO – แอนไอออนถูกกำหนดโดยความเข้มข้นของไอออนที่เกิดจากการแตกตัวของเกลือ ซึ่งจะเท่ากับความเข้มข้นของเกลือ (c s ) นั่นคือโซเดียมอะซิเตต ความเข้มข้นสูงของแอนไอออนเหล่านี้ทำให้ความเข้มข้นของไอออนบวก H + ลดลง และส่งผลให้ระดับการแยกตัวของกรดลดลงเพื่อรักษาค่า K ให้ คงที่ เนื่องจากความสัมพันธ์นี้ เราสามารถสรุปได้ว่าจำนวนของโมเลกุล CH 3 COOH ที่ไม่แยกออกจากกันนั้นเกือบจะเหมือนกับความเข้มข้นทั้งหมดของกรดอะซิติก (c k ) นี่คือสาเหตุที่สามารถบันทึกค่าคงที่การแยกตัวได้ดังนี้: 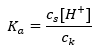 เมื่อใช้ลอการิทึมแล้ว เราได้รับความสัมพันธ์ที่นำไปสู่สมการ Henderson-Hasselbach:
เมื่อใช้ลอการิทึมแล้ว เราได้รับความสัมพันธ์ที่นำไปสู่สมการ Henderson-Hasselbach: 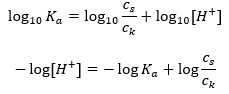 ดังนั้น สมการ Henderson-Hasselbach จึงมีรูปแบบดังนี้
ดังนั้น สมการ Henderson-Hasselbach จึงมีรูปแบบดังนี้ 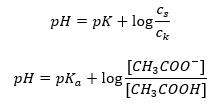 ในการเขียน ความ สัมพันธ์ ค่า pK ในสมการคือการวัดความแรงของกรด ค่า pK a ใดๆ ที่ต่ำกว่า 3 (-log(0.001)) เป็นลักษณะของกรดแก่ ในขณะที่ค่ายิ่งสูง กรดยิ่งอ่อน ความจริงที่เกิดจากสมการเฮนเดอร์สัน-ฮัสเซิลบาคคือค่า pH ของสารละลายบัฟเฟอร์และค่า pK a ของกรด ณ ขณะนั้น เมื่ออัตราส่วนของความเข้มข้นของกรดที่ไม่แยกตัวกับความเข้มข้นของแอนไอออนที่เกิดจากการแตกตัว ของกรดเท่ากับ 1 โดยที่ล็อก(1) เท่ากับ 0 สภาวะดังกล่าวเกิดขึ้นจากการไทเทรตกรดอ่อนกับเบสแก่ หากเราเพิ่มเบสแก่ในปริมาณที่เท่ากับครึ่งหนึ่งของปริมาณที่จำเป็นสำหรับการทำให้เป็นกลางโดยสมบูรณ์ ของกรด จากนั้นระดับการไทเทรตของสารละลายคือ 50%ในการพึ่งพาระหว่างค่า pH และปริมาตรของไตแตรนต์ที่ใช้ ค่า pH ในพื้นที่บัฟเฟอร์จะเปลี่ยนแปลงค่อนข้างช้า
ในการเขียน ความ สัมพันธ์ ค่า pK ในสมการคือการวัดความแรงของกรด ค่า pK a ใดๆ ที่ต่ำกว่า 3 (-log(0.001)) เป็นลักษณะของกรดแก่ ในขณะที่ค่ายิ่งสูง กรดยิ่งอ่อน ความจริงที่เกิดจากสมการเฮนเดอร์สัน-ฮัสเซิลบาคคือค่า pH ของสารละลายบัฟเฟอร์และค่า pK a ของกรด ณ ขณะนั้น เมื่ออัตราส่วนของความเข้มข้นของกรดที่ไม่แยกตัวกับความเข้มข้นของแอนไอออนที่เกิดจากการแตกตัว ของกรดเท่ากับ 1 โดยที่ล็อก(1) เท่ากับ 0 สภาวะดังกล่าวเกิดขึ้นจากการไทเทรตกรดอ่อนกับเบสแก่ หากเราเพิ่มเบสแก่ในปริมาณที่เท่ากับครึ่งหนึ่งของปริมาณที่จำเป็นสำหรับการทำให้เป็นกลางโดยสมบูรณ์ ของกรด จากนั้นระดับการไทเทรตของสารละลายคือ 50%ในการพึ่งพาระหว่างค่า pH และปริมาตรของไตแตรนต์ที่ใช้ ค่า pH ในพื้นที่บัฟเฟอร์จะเปลี่ยนแปลงค่อนข้างช้า 
ตัวอย่าง: บัฟเฟอร์แอมโมเนียม
บัฟเฟอร์อีกประเภทหนึ่งคือแอมโมเนียมบัฟเฟอร์ซึ่งเป็นส่วนผสมของเบสอ่อน (NH 4 OH) กับกรดแก่ (NH 4 Cl) อย่างไรก็ตามกลไกนี้คล้ายกันมาก เกลือที่มีอยู่ในของผสมผ่านการแยกตัวออกอย่างสมบูรณ์ และค่าคงที่ของมันคือสมการต่อไปนี้: 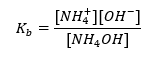 ในขณะที่เบสแอมโมเนียมนั้นแทบจะไม่แยกออกจากกันในอิเล็กโทรไลต์เข้มข้น (NH 4 Cl) ด้วยเหตุผลนี้ เราสันนิษฐานว่าความเข้มข้นของ NH 4 + ไอออนบวกเท่ากับความเข้มข้นของเกลือ แต่ความเข้มข้นของโมเลกุล NH 4 OH ที่ไม่แยกตัวจะเหมือนกับความเข้มข้นของเบส สิ่งนี้ทำให้สามารถกำหนดสมการและคำนวณค่า pH ของบัฟเฟอร์นั้นได้
ในขณะที่เบสแอมโมเนียมนั้นแทบจะไม่แยกออกจากกันในอิเล็กโทรไลต์เข้มข้น (NH 4 Cl) ด้วยเหตุผลนี้ เราสันนิษฐานว่าความเข้มข้นของ NH 4 + ไอออนบวกเท่ากับความเข้มข้นของเกลือ แต่ความเข้มข้นของโมเลกุล NH 4 OH ที่ไม่แยกตัวจะเหมือนกับความเข้มข้นของเบส สิ่งนี้ทำให้สามารถกำหนดสมการและคำนวณค่า pH ของบัฟเฟอร์นั้นได้ 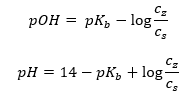 โมเลกุล NH 4 + และ Cl – ไอออน และ NH 4 OH ที่มีอยู่ในแอมโมเนียมบัฟเฟอร์ส่งผลให้เมื่อเราเติมกรดหรือเบสลงไป ปฏิกิริยาต่อไปนี้จะเกิดขึ้น: NH 4 OH + H + ↔ NH 4 + + H 2 O NH 4 + + OH – ↔ NH 4 OH หากเติมเพียงเล็กน้อย การเปลี่ยนแปลงอัตราส่วนความเข้มข้นของเบสต่อเกลือ และการเปลี่ยนแปลงของค่า pH ก็จะน้อยเช่นกัน ในกรณีที่อัตราส่วนของความเข้มข้นเหล่านี้เปลี่ยนแปลงสิบเท่า ค่า pH จะเปลี่ยนหนึ่งหน่วย
โมเลกุล NH 4 + และ Cl – ไอออน และ NH 4 OH ที่มีอยู่ในแอมโมเนียมบัฟเฟอร์ส่งผลให้เมื่อเราเติมกรดหรือเบสลงไป ปฏิกิริยาต่อไปนี้จะเกิดขึ้น: NH 4 OH + H + ↔ NH 4 + + H 2 O NH 4 + + OH – ↔ NH 4 OH หากเติมเพียงเล็กน้อย การเปลี่ยนแปลงอัตราส่วนความเข้มข้นของเบสต่อเกลือ และการเปลี่ยนแปลงของค่า pH ก็จะน้อยเช่นกัน ในกรณีที่อัตราส่วนของความเข้มข้นเหล่านี้เปลี่ยนแปลงสิบเท่า ค่า pH จะเปลี่ยนหนึ่งหน่วย
ความจุบัฟเฟอร์
คำว่า “ความจุของบัฟเฟอร์” หมายถึงความจุของสารละลายบัฟเฟอร์เพื่อรักษาความเป็นกรดของสารละลายให้คงที่โดยประมาณ แม่นยำยิ่งขึ้น มันคือจำนวนของกรดแก่หรือเบสแก่ที่เทียบเท่ากรัม ซึ่งเมื่อเติมสารละลายบัฟเฟอร์ลงใน 1 dm 3 ค่า pH จะเปลี่ยนค่า pH ของมันไปหนึ่ง สูตรที่กำหนดความจุของบัฟเฟอร์ (β) รวมถึงการขึ้นกับจำนวนโมลของกรด/เบสแก่หลังจากเติมสารละลายบัฟเฟอร์ (Δn, [ml]) และการเปลี่ยนแปลงค่า pH ที่สังเกตได้ขณะเติม ปริมาตรของกรดแก่หรือเบสแก่สารละลายบัฟเฟอร์ (ΔpH) ![]() เป็นค่าที่เกี่ยวข้องอย่างมากกับความเข้มข้นของส่วนผสม ซึ่งเพิ่มขึ้นเมื่อเพิ่มขึ้น ค่าสูงสุดของความจุบัฟเฟอร์แสดงลักษณะของสารละลายบัฟเฟอร์ที่มีค่า pH เท่ากับค่าคงที่การแยกตัว (pK a ) ของกรดที่ใช้ในการผลิต
เป็นค่าที่เกี่ยวข้องอย่างมากกับความเข้มข้นของส่วนผสม ซึ่งเพิ่มขึ้นเมื่อเพิ่มขึ้น ค่าสูงสุดของความจุบัฟเฟอร์แสดงลักษณะของสารละลายบัฟเฟอร์ที่มีค่า pH เท่ากับค่าคงที่การแยกตัว (pK a ) ของกรดที่ใช้ในการผลิต
หลักการทำงานของบัฟเฟอร์ฟอสเฟต
บัฟเฟอร์ประเภทที่ได้รับความนิยมน้อยกว่าคือบัฟเฟอร์ที่มีเกลือของกรดสองชนิด ในกรณีนี้ พวกมันคือเกลือของกรดออร์โธฟอสฟอริก (V) สองชนิด นั่นคือโซเดียมฟอสเฟตโมโนเบสิก (V) และโซเดียมฟอสเฟตไดเบสิก (V) ไม่เหมือนกับบัฟเฟอร์ทั่วไปซึ่งอิงตามหลักการของคู่กรด-เบสของคอนจูเกตของBrønsted ลักษณะของส่วนผสมนั้นไม่ง่ายเลยที่จะระบุ เนื่องจากแอนไอออนที่มีอยู่ในฟอสเฟตบัฟเฟอร์แสดงค่าคุณลักษณะเฉพาะของกรดเบรินสเตด เราควรตรวจสอบความแตกต่างระหว่างทั้งสองอย่างระมัดระวังมากขึ้น ตามหลักการนั้น ไอออนที่เป็นกรดแก่จะต้องมีค่าคงที่การแยกตัวที่สูงกว่า
- สำหรับ H 2 PO 4 – K a = 6.34·10 -8
- สำหรับ HPO 4 -2 K a = 4.36·10 -13
หากเรามีข้อมูลดังกล่าว เราสามารถระบุได้อย่างง่ายดายว่าในกรณีนี้คือไอออนไฮโดรเจน H 2 PO 4 -13 ซึ่งเป็นกรดเบรินสเตดอย่างอ่อน กลไกการทำงานของบัฟเฟอร์ขึ้นอยู่กับสมดุลไดนามิกที่สามารถแสดงได้ด้วยสมการต่อไปนี้: ![]() หากเราเติมกรดจำนวนเล็กน้อยลงในสารละลายบัฟเฟอร์ ระบบจะพยายามป้องกันการเปลี่ยนแปลงค่า pH เนื่องจากปฏิกิริยาการปิดกั้นผลกระทบของไอออนบวก [H +] โดยโปรตอนไฮโดรเจนไอออน ตามข้อมูลต่อไปนี้ สมการ:
หากเราเติมกรดจำนวนเล็กน้อยลงในสารละลายบัฟเฟอร์ ระบบจะพยายามป้องกันการเปลี่ยนแปลงค่า pH เนื่องจากปฏิกิริยาการปิดกั้นผลกระทบของไอออนบวก [H +] โดยโปรตอนไฮโดรเจนไอออน ตามข้อมูลต่อไปนี้ สมการ: ![]() ความจริงที่ว่ามันเป็นไอออนที่จะทำให้บัฟเฟอร์ที่เติมเข้าไปในสารละลายเป็นกลางนั้นเป็นผลมาจากข้อเท็จจริงที่ว่าไอออนนั้นเป็นเบสของเบรินสเตดที่แรงกว่า ในระบบดังกล่าว เราใช้กฎที่ระบุว่ายิ่งกรดเบรินสเตดเข้มข้นเท่าใด เบสคอนจูเกตก็ยิ่งอ่อนลงเท่านั้น หากเราเติมกรดลงไปในระบบที่มีเบสของเบรินสเตดหลายตัว เบสที่แรงที่สุดจะเป็นเบสตัวแรกที่ทำปฏิกิริยา ความสัมพันธ์นี้เป็นองค์ประกอบที่สำคัญที่สุดในการวิเคราะห์สมดุลที่มีอยู่ในของผสมของสารละลายบัฟเฟอร์ที่เป็นน้ำซึ่งประกอบด้วยของผสมของกรดเบรินสเตดและของผสมของเบสของเบรินสเตดอย่างอ่อน กฎเดียวกันแต่ในลำดับย้อนกลับ ใช้เมื่อเราเติมสารละลายพื้นฐานลงในฟอสเฟตบัฟเฟอร์ OH – แอนไอออนจะถูกจับโดยกรดเบรินสเตดที่แรงกว่าซึ่งอยู่ในบัฟเฟอร์แทบจะในทันที ในกรณีนี้ นี่จะเป็นไอออน และปฏิกิริยาจะเกิดขึ้นตามสมการต่อไปนี้:
ความจริงที่ว่ามันเป็นไอออนที่จะทำให้บัฟเฟอร์ที่เติมเข้าไปในสารละลายเป็นกลางนั้นเป็นผลมาจากข้อเท็จจริงที่ว่าไอออนนั้นเป็นเบสของเบรินสเตดที่แรงกว่า ในระบบดังกล่าว เราใช้กฎที่ระบุว่ายิ่งกรดเบรินสเตดเข้มข้นเท่าใด เบสคอนจูเกตก็ยิ่งอ่อนลงเท่านั้น หากเราเติมกรดลงไปในระบบที่มีเบสของเบรินสเตดหลายตัว เบสที่แรงที่สุดจะเป็นเบสตัวแรกที่ทำปฏิกิริยา ความสัมพันธ์นี้เป็นองค์ประกอบที่สำคัญที่สุดในการวิเคราะห์สมดุลที่มีอยู่ในของผสมของสารละลายบัฟเฟอร์ที่เป็นน้ำซึ่งประกอบด้วยของผสมของกรดเบรินสเตดและของผสมของเบสของเบรินสเตดอย่างอ่อน กฎเดียวกันแต่ในลำดับย้อนกลับ ใช้เมื่อเราเติมสารละลายพื้นฐานลงในฟอสเฟตบัฟเฟอร์ OH – แอนไอออนจะถูกจับโดยกรดเบรินสเตดที่แรงกว่าซึ่งอยู่ในบัฟเฟอร์แทบจะในทันที ในกรณีนี้ นี่จะเป็นไอออน และปฏิกิริยาจะเกิดขึ้นตามสมการต่อไปนี้: ![]()
บัฟเฟอร์ที่รู้จักและแอปพลิเคชัน
- เลือดคงค่าไว้ที่ 7.35 และ 7.45 หน่วย และรับประกันความเสถียรด้วยการมีอยู่ของกรดคาร์บอนิก ซึ่งส่วนใหญ่อยู่ในรูปของคาร์บอนไดออกไซด์ที่ละลายน้ำและ HCO 3- เป็นบัฟเฟอร์ที่เป็นกรดอ่อนและเกลือของมัน และการเติมใดๆ ของ กรดหรือเบสในปริมาณที่มากเกินไปจะทำให้เกิดสภาวะที่เป็นอันตรายต่อชีวิตมนุษย์ ตัวอย่างที่คล้ายกันของบัฟเฟอร์คือน้ำลาย ซึ่งมีค่า pH อยู่ที่ประมาณ 7
- แอมโมเนียม อะซีเตต ฟอสเฟต และบอเรตบัฟเฟอร์ ดังนั้นตามลำดับ:
- NH 3 + NH 4 Cl pH = 8 – 11;
- CH 3 COOH + CH 3 COONa pH 3,5 – 6;
- K 2 HPO 4 + KH 2 PO 4 pH = 5,5 – 8;
- H 3 BO 3 + Na 2 B 4 O 7 pH = 7 – 9
บัฟเฟอร์ยอดนิยมทั้งหมดถูกนำมาใช้เมื่อจำเป็นต้องรักษาค่า pH ให้อยู่ในระดับคงที่ ตัวอย่างเช่น:
- ในทางการแพทย์โดยให้ทางหลอดเลือดดำแก่ผู้ป่วยในภาวะวิกฤต
- ในการเพาะเลี้ยงจุลินทรีย์ซึ่งปฏิกิริยาของดินเป็นปัจจัยสำคัญ
- ในการทำงานร่วมกับเอ็นไซม์และโปรตีน เพื่อทำให้สภาพแวดล้อมเสถียรสำหรับปฏิกิริยาเคมี
- ในการชุบด้วยไฟฟ้าซึ่งใช้สำหรับอ่างอิเล็กโทรไลต์เนื่องจากช่วยป้องกันการเปลี่ยนแปลงค่า pH อย่างรวดเร็วและรุนแรงในบริเวณใกล้กับอิเล็กโทรด
- สำหรับการสอบเทียบเครื่องวัดค่า pH

