Шкала pH применяется для определения степени кислотности или щелочности раствора по количественной шкале, содержащей абсолютные числа от 0 до 14. Она основана на молярной активности ионов гидроксония (называемых еще гидрониевыми ионами) [H3O+] в исследуемой жидкости. Шкалу разработал в 1909 году датский биохимик С. Соренсен, а присутствующие в названии буквы «p» и «H» означают, в свою очередь, латинское слово «potentio» — сила, а также атом водорода, записанный в таблице Менделеева как H (hydrogenium), соответственно. Шкала pH отражает и первое, и второе — для определения реакции используется показатель степени с противоположным знаком, а опорной точкой являются водородсодержащие протоны. Реакция каждого полученного раствора является важной химической характеристикой этого раствора и фактором, определяющим ход и скорость многих химических реакций, а также тип образующихся в них продуктов.

Различие в шкале
Шкала pH имеет пятнадцать степеней, где среднее значение 7 указывает на нейтральную реакцию. Растворы, расположенные около 0, называются сильными кислотами, а растворы, расположенные на противоположной стороне, около 14, называются сильными основаниями. Кислая реакция свидетельствует об избытке ионов водорода [H3O+] в растворе, щелочная реакция — об избытке гидроксильных ионов [OH—]. Шкала pH чаще всего упоминается в контексте растворов, однако абсолютный химический потенциал протона позволяет применять ее ко всем агрегатным состояниям. Таким образом, она позволяет напрямую сравнивать уровень щелочности практически любого вещества.
Автодиссоциация воды
Чтобы в полной степени понять значение шкалы pH, необходимо провести реакцию спонтанной автодиссоциации воды в соответствии с уравнением:

Это обратимый процесс, константа равновесия которого смещена в левую часть уравнения, то есть в сторону недиссоциированной воды.
Как рассчитать реакцию pH?
Несмотря на изначально неверно определенное предположение, что определяется концентрация ионов водорода [H+], наиболее часто используемым уравнением все же является:

Однако в настоящее время известно, что растворы вообще не содержат свободных ионов водорода, т. е. протонов, присутствующих в формуле, из-за процесса немедленной сольватации. Это явление приводит к отсутствию свободных протонов в пользу присутствия ионов гидроксония [H3O+] вследствие спонтанной, необратимой реакции:
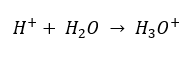
Поэтому правильная формула имеет следующий вид:
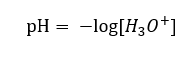
Среда, отображаемая на шкале pH
Предполагается, что концентрация ионов гидроксония в чистой воде при комнатной температуре 25 oC равна 10-7 моль/дм3, а следовательно ее реакцию можно рассчитать по шкале pH как:
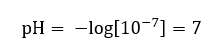
Это согласуется с тем, что вода, будучи нейтральной, находится в середине шкалы, что указывает на нейтральность реакции вещества. Это также означает, что в воде имеется равное количество гидроксильных анионов и гидрониевых катионов. В кислотах и основаниях, однако, этот баланс нарушается. Показатель степени со знаком «минус» предполагает зависимость, что чем меньше значение pH, тем больше сила исследуемого раствора. Термин «сила» в случае со шкалой pH означает, что значение 0 принимают сильные, даже едкие кислоты, а значение 14 относится к самым сильным щелочным реакциям.
Добавление кислоты в воду
Изменение pH по сравнению с нейтральной реакцией можно вызвать добавлением веществ различной силы. Например, добавление одной из самых сильных кислот, хлористоводородной HCl, к воде вызывает ее диссоциацию, согласно реакции:

Равновесие реакции диссоциации кислоты, в отличие от автодиссоциации воды, сильно смещено в правую сторону продуктов. Это приводит к тому, что растворение данной кислоты в нейтральной воде повышает число присутствующих в ней ионов гидроксония и, таким образом, увеличивает их молярную активность. Например, соляная кислота объемом 1 моль/дм3 согласно реакции диссоциации, вносит в раствор ионы гидроксония с концентрацией 1 моль/дм3. Рассчитать pH для такого раствора хлористоводородной кислоты можно по формуле:
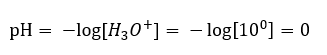
Добавление основания к воде
В случае обратной ситуации — добавлении к воде сильного основания концентрация ионов гидроксония будет уменьшаться. Например, гидроксид натрия с концентрацией 1 моль/дм3 будет иметь такую же концентрацию, но других ионов — гидроксильных, в соответствии с реакцией, которую он претерпевает при контакте с водой:

В таком случае рассчитать pH можно косвенно, используя дополнительную формулу для pOH:
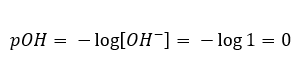
Зная это:
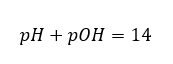
легко подсчитать, что pH раствора сильного основания NaOH с концентрацией 1 моль/дм3 имеет значение pH, равное 14.

Реакция pH выходит за пределы шкалы?
Поскольку шкала pH изначально была создана для разбавленных растворов, сильные кислоты или основания могут выходить за ее пределы, т. е. ниже 0 или выше 14. Это связано с тем, что шкала не подходит для высоких концентраций, где реакция уже не является логарифмической функцией концентрации ионов гидроксония [H3O+]. В таком случае используются другие значения, которые получаются из констант равновесия автодиссоциации кислот и оснований.
Методы определения pH раствора
Для эмпирического определения реакции среды применяются так называемые алкациметрические индикаторы. На практике это вещества, которые под воздействием различных условий pH меняют свой цвет. Существует три типа таких индикаторов:
- Например, те, которые меняют цвет в щелочной среде:
- бесцветный фенолфталеин меняет цвет на малиновый,
- бесцветный тимолфталеин меняет цвет на синий.
- Меняющие цвет в кислой среде, например:
- метиловый оранжевый меняет цвет с оранжевого на красный,
- бромфеноловый синий меняет цвет с синего на желтый.
- Универсальные показатели, например:
- бромтимоловый синий в кислотах окрашивается в желтый цвет, в основаниях — в синий,
- лакмус в кислотах окрашивается в красный цвет, в основаниях — в синий.
Также распространена практика замачивания лакмусовой бумаги в смеси различных индикаторных веществ, благодаря чему расширяется диапазон перечня pH. Кроме того, в лабораториях часто применяются готовые универсальные индикаторные бумаги, которые окрашиваются, например, от красного до зеленого цвета, а это предполагает соответствующий проверенный pH, на основании приложенной к ним шкалы. Такая индикация позволяет оценить значение pH только с точностью до 0,5 единиц по шкале pH.
Более точным методом измерения реакции pH является алкалиметрическое титрование, которое подразделяется на алкалиметрию (титрование стандартным раствором щелочи) и ацидиметрию (титрование стандартным раствором кислоты). Для этого применяется титрант с известной концентрацией, который, реагируя с исследуемым веществом, меняет концентрацию ионов гидроксония, присутствующих в растворе. Это определение может осуществляться двумя способами — конечная точка определяется визуально по изменению цвета или с помощью инструментальных методов, например, потенциометрически или кондуктометрически.
Применение pH-метра, как следует из названия, также позволяет определить реакцию вещества. Аппарат, работающий на принципах потенциометрии, имеет ячейку с двумя одинаковыми электродами. Один из них, называемый индикаторным электродом, необходимо поместить в исследуемый раствор. Другой электрод, который является электродом сравнения, помещается в стандартный раствор с известным pH. Часто применяется раствор хлорида серебра. Эти электроды соединены с очень чувствительным вольтметром, который на ходу преобразует ЭДС, т. е. значение измерений электродвижущей силы, в конкретный результат на шкале pH. Согласно теории Нернста, электродвижущая сила ячейки (ЭДС), состоящей из двух одинаковых электродов, погруженных в растворы, отличающиеся с точки зрения реакций, прямо пропорциональна логарифму коэффициента этих концентраций.
Домашние методы измерения pH
Оказывается, существует множество природных индикаторов pH, и можно измерить приблизительное значение pH в домашних условиях. Например, настой листьев черного чая становится светлее при добавлении кислоты, например, лимонного сока. С другой стороны, этот настой темнеет под воздействием щелочей, например, раствора пищевой соды. Сок красной капусты в присутствии кислоты из фиолетового становится красным, а при добавлении щелочи — синим.
