Skala pH służy nam do określenia stopnia kwasowości lub zasadowości roztworu na skali ilościowej, która zawiera liczby bezwzględne od 0 do 14. Opiera się na aktywności molowej jonów hydroniowych [H3O+] w badanej cieczy. Skala, opracowana została w 1909r. przez duńskiego biochemika S. Sorensena, a obecne w nazwie litery „p” i „H” oznaczają kolejno, łacińskie słowo potentio – potęga oraz atom wodoru, zapisany w tablicy Mendelejewa jako H (hydrogenium). Skala pH odzwierciedla jedno i drugie – aby określić odczyn wykorzystujemy wykładnik potęgi o zmienionym znaku, a odnośnikiem są protony zawierające wodór. Odczyn każdego powstałego roztworu jest jego ważną cechą chemiczną i jest czynnikiem determinującym przebieg oraz szybkość wielu reakcji chemicznych, a także rodzaj powstających w nich produktów.

Rozróżnienie w skali
Skala pH posiada piętnaście stopni, gdzie środkowa wartość – 7 oznacza odczyn neutralny, obojętny. Roztwory umiejscowione w okolicy 0 nazywamy silnymi kwasami, natomiast po przeciwnej stronie, w pobliżu 14 – silnymi zasadami. Odczyn kwasowy świadczy o obecnym w roztworze nadmiarze ilości jonów wodorowych [H3O+], zasadowy o nadmiarze jonów wodorotlenowych [OH–]. Najczęściej mówi się o skali pH w kontekście roztworów, jednak absolutny potencjał chemiczny protonu pozwala na jej zastosowanie we wszystkich stanach skupienia. Dzięki temu, pozwala na bezpośrednie porównywanie poziomu zasadowości praktycznie każdej substancji.
Autodysocjacja wody
W celu pełnego zrozumienia sensu istnienia skali pH, nieodłącznym elementem jest samorzutna reakcja autodysocjacji wody, przebiegająca zgodnie z równaniem:

Jest to proces odwracalny, którego stała równowagi jest przesunięta w lewą stronę równania, czyli w kierunku wody niezdysocjowanej.
Jak obliczyć odczyn pH?
Pomimo błędnie zdefiniowanego początkowo założenia, że oznaczane jest stężenie jonów wodorowych [H+], nadal najpowszechniej używanym wzorem jest:

Obecnie wiadomo jednak, że roztwory wcale nie zawierają wolnych jonów wodorowych, czyli obecnych we wzorze protonów, ze względu na natychmiastowy proces solwatowania. Zjawisko skutkuje brakiem wolnych protonów, na rzecz występowania jonów hydroniowych [H3O+], ze względu na samorzutną, nieodwracalną reakcję:
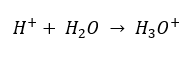
Z tego względu, poprawny zapis wzoru to:
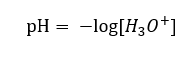
Środowisko, oznaczone w skali pH
Przyjmuje się, że stężenie jonów hydroniowych w czystej wodzie, w temperaturze pokojowej 25oC jest równe 10-7 mol/dm3, a więc jej odczyn w skali pH możemy obliczyć jako:
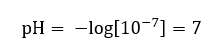
Jest to zgodne z faktem, iż woda będąc neutralna, znajduje się w połowie skali, świadczącej o obojętności odczynu substancji. Oznacza to również, że w wodzie znajduje się równa ilość anionów wodorotlenowych oraz kationów hydroniowych. W kwasach oraz zasadach, ta równowaga jest jednak zaburzona. Ujemny wykładnik potęgi sugeruje zależność, że im mniejsza wartość pH, tym większa moc badanego roztworu. Określenie „moc” w przypadku skali pH odnosi się do faktu, iż wartość 0 przyjmują silne, wręcz żrące kwasy, natomiast wartość 14 odnosi się do najsilniejszych odczynów alkalicznych.
Dodatek kwasu do wody
Zmianę pH z odczynu obojętnego mogą wywołać dodatki substancji o różnych mocach. Na przykład, dodatek jednego z najsilniejszych kwasów, chlorowodorowego HCl do wody powoduje jego dysocjację, według reakcji:

Równowaga reakcji dysocjacji kwasu jest, w przeciwieństwie do autodysocjacji wody, przesunięta silnie w stronę prawą, produktów. Skutkuje to faktem, iż rozpuszczenie tego kwasu w obojętnej środowiskowo wodzie, spowoduje podniesienie ilości obecnych w niej jonów hydroniowych, a co za tym idzie, wzrost ich aktywności molowej. Dla przykładu, kwas solny o stężeniu 1 mol/dm3, zgodnie z reakcją dysocjacji, wprowadza do roztworu jony hydroniowe o stężeniu 1mol/dm3. Odczyn pH dla takiego roztworu kwasu chlorowodorowego możemy obliczyć na podstawie wzoru:
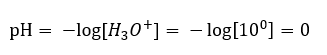
Dodatek zasady do wody
W przypadku odwrotnej sytuacji, dodatku silnej zasady do wody, stężenie jonów hydroniowych ulegnie zmniejszeniu. Przykładowo, wodorotlenek sodu o stężeniu 1mol/dm3 analogicznie będzie posiadał takie samo stężenie, ale innych jonów – wodorotlenowych, zgodnie z reakcją, której ulega pod wpływem wody:

W takim przypadku, możliwe jest pośrednie obliczenie pH, posługując się dopełniającym wzorem na pOH:
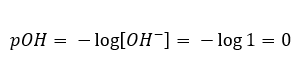
Wiedząc, że:
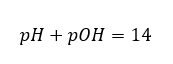
łatwo obliczyć, że pH roztworu silnej zasady, NaOH o stężeniu 1mol/dm3 posiada wartość pH równą 14.

Odczyn pH poza skalą?
Ze względu na to, iż skala pH początkowo została stworzona na potrzeby roztworów rozcieńczonych, możliwe jest wykraczanie silnych kwasów lub zasad poza nią, czyli poniżej 0 lub powyżej 14. Dzieje się tak, ponieważ skala nie sprawdza się dla wysokich stężeń, gdzie odczyn przestaje być logarytmiczną funkcją stężenia jonów hydroniowych [H3O+]. Wtedy, korzysta się z innych wartości, które wynikają ze stałych równowag autodysocjacji kwasów i zasad.
Metody oznaczania pH roztworu
Do empirycznego oznaczenia odczynu środowiska służą, tak zwane, wskaźniki alkacymetryczne. W praktyce, są to substancje, które pod wpływem różnych warunków pH, zmieniają swoją barwę. Są trzy typy takich wskaźników:
- Zmieniające barwę w środowisku zasadowym, na przykład:
- bezbarwna fenoloftaleina zmienia kolor na malinowy,
- bezbarwna tymoloftaleina zmienia kolor na niebieski.
- Zmieniające barwę w środowisku kwasowym, na przykład:
- oranż metylowy zmienia barwę z pomarańczowego na czerwony,
- błękit bromofenolowy zmienia barwę z niebieskiego na żółtą.
- Wskaźniki uniwersalne, na przykład:
- błękit bromotymolowy w kwasach barwi się na żółto, w zasadach na niebiesko,
- lakmus w kwasach barwi się na czerwono, w zasadach na niebiesko.
Często praktykuje się również namaczanie papierków lakmusowych w mieszaninie różnych substancji wskaźnikowych, dzięki czemu powiększa się zakres wykazu pH. Ponadto, często w laboratoriach stosowane są gotowe, uniwersalne papierki wskaźnikowe, które zabarwiają się na przykład od czerwonego po zielony, sugerując odpowiednio zbadane pH, na podstawie dołączonej do nich skali. Takie oznaczenie pozwala jedynie na oszacowanie wartości pH z dokładnością do 0,5 jednostki w skali pH.
Bardziej precyzyjną metodą pomiaru odczynu pH jest miareczkowanie alkacymetryczne, o podtypach alkalimetrii (miareczkowanie mianowanym roztworem zasady) oraz acydymetrii (miareczkowanie mianowanym roztworem kwasu). Wykorzystuje ona titrant, o znanym stężeniu, który wchodząc w reakcję z badaną substancją, zmienia ciągle obecne w roztworze stężenie jonów hydroniowych. Takie oznaczenie może się odbyć dwojako – przy wyznaczeniu punktu końcowego wizualnie, ze zmianą barwną lub z wykorzystaniem metod instrumentalnych, na przykład potencjometrycznie lub konduktometrycznie.
Wykorzystanie pH-metru, jak sama nazwa wskazuje, również umożliwia nam określenie odczynu substancji. Aparat, działający na zasadach potencjometrii, posiada ogniwo o dwóch takich samych elektrodach. Jedną z nich, nazywaną elektrodą wskaźnikową, należy umieścić w roztworze badanym. Druga, będąca elektrodą porównawczą, znajduje się w roztworze wzorcowym o znanym pH. Często wykorzystywany jest roztwór chlorku srebra. Te elektrody połączone są bardzo czułym woltomierzem, który przelicza na bieżąco SEM, czyli wartość pomiarów siły elektromotorycznej, na konkretny wynik w skali pH. Według teorii Nernsta, siła elektromotoryczna ogniwa (SEM), składająca się z dwóch identycznych elektrod, zanurzonych w różnych pod względem odczynów roztworach, jest wprost proporcjonalna do logarytmu ilorazu tych stężeń.
Domowe sposoby zmierzenia pH
Okazuje się, że istnieje wiele naturalnych wskaźników pH, a orientacyjną wartość odczynu możemy zmierzyć w warunkach domowych. Przykładowo, napar z liści czarnej herbaty jaśnieje pod wpływem dodawania kwasu, np. soku z cytryny. Napar ten ciemnieje zaś pod wpływem zasad, takich jak roztwór sody oczyszczonej. Sok z czerwonej kapusty, w obecności kwasu, z fioletowego staje się czerwony, a po dodaniu zasady – niebieski.
