La scala del pH viene utilizzata per determinare il grado di acidità o alcalinità di una soluzione su una scala quantitativa che contiene i numeri assoluti da 0 a 14. Si basa sull'attività molare degli ioni idronio [H 3 O +] nel liquido testato. La scala è stata sviluppata nel 1909 dal biochimico danese S. Sorensen, e le lettere 'p' e 'H' stanno rispettivamente per il latino 'potentio' (potenza) e l'atomo di idrogeno, che è indicato nella tavola periodica come 'H' (idrogeno). La scala del pH riflette sia l'una che l'altra: per determinare il livello di pH, usiamo l'esponente di potenza con segno cambiato per riferirci ai protoni contenenti idrogeno. Il livello di pH di qualsiasi soluzione prodotta è una delle sue caratteristiche chimiche più importanti e un fattore che determina il corso e la velocità di molte reazioni chimiche, nonché il tipo di sostanze prodotte.

Differenziazione sulla scala
La scala del pH comprende quindici gradi, dove il valore medio (7) indica un pH neutro. Le soluzioni posizionate vicino a 0 sono chiamate acidi forti, mentre quelle sul lato opposto, vicino a 14, sono chiamate basi forti. Un pH acido significa che la soluzione contiene troppi ioni idrogeno [H 3 O +], e un pH basico significa che ci sono troppi ioni idrossido [OH –]. La scala del pH è più spesso indicata nel contesto delle soluzioni, ma il potenziale chimico assoluto di un protone la rende applicabile in tutti gli stati di aggregazione. Questo ci consente di confrontare direttamente il livello di alcalinità di praticamente qualsiasi sostanza.
Autodissociazione dell’acqua
Per comprendere appieno il senso della scala del pH, abbiamo bisogno della reazione spontanea di autodissociazione dell’acqua, che procede secondo la seguente equazione:  È un processo reversibile la cui costante di equilibrio è spostata verso il lato sinistro dell’equazione, cioè verso l’acqua non dissociata.
È un processo reversibile la cui costante di equilibrio è spostata verso il lato sinistro dell’equazione, cioè verso l’acqua non dissociata.
Come calcolare il livello di pH?
Nonostante l’ipotesi iniziale erroneamente definita che la determinazione riguardi la concentrazione di ioni idrogeno [H +], la formula più popolare è ancora la seguente:  Già oggi sappiamo che le soluzioni non contengono ioni idrogeno acquosi, cioè protoni presenti nell’acqua, a causa dell’immediato processo di solvatazione. Il fenomeno si traduce nella mancanza di protoni liberi e nella presenza di ioni idronio [H 3 O +], causata dalla reazione spontanea e irreversibile:
Già oggi sappiamo che le soluzioni non contengono ioni idrogeno acquosi, cioè protoni presenti nell’acqua, a causa dell’immediato processo di solvatazione. Il fenomeno si traduce nella mancanza di protoni liberi e nella presenza di ioni idronio [H 3 O +], causata dalla reazione spontanea e irreversibile: 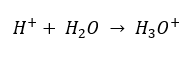 Pertanto, la corretta notazione della formula è la seguente:
Pertanto, la corretta notazione della formula è la seguente: 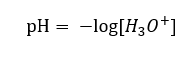
Ambiente indicato sulla scala del pH
Si presume che la concentrazione di ioni idronio in acqua pura a temperatura ambiente (25 o C) sia di 10 -7 mol/dm 3 , quindi il suo livello di pH può essere calcolato come segue: 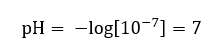 Ciò è in linea con il fatto che l’acqua, essendo neutra, è posizionata al centro della scala, il che indica l’inerzia chimica della sostanza. Dimostra anche che l’acqua contiene un numero uguale di anioni idrossido e cationi idronio. Negli acidi e nelle basi, tuttavia, tale equilibrio è disturbato. Un esponente negativo suggerisce una relazione in cui più basso è il livello di pH, maggiore è la potenza della soluzione testata. Il termine ‘potere’ nel contesto della scala del pH si riferisce al fatto che il valore 0 è assunto da acidi forti, anche irritanti, mentre il valore 14 si riferisce alle sostanze alcaline più forti.
Ciò è in linea con il fatto che l’acqua, essendo neutra, è posizionata al centro della scala, il che indica l’inerzia chimica della sostanza. Dimostra anche che l’acqua contiene un numero uguale di anioni idrossido e cationi idronio. Negli acidi e nelle basi, tuttavia, tale equilibrio è disturbato. Un esponente negativo suggerisce una relazione in cui più basso è il livello di pH, maggiore è la potenza della soluzione testata. Il termine ‘potere’ nel contesto della scala del pH si riferisce al fatto che il valore 0 è assunto da acidi forti, anche irritanti, mentre il valore 14 si riferisce alle sostanze alcaline più forti.
L’aggiunta di acido in acqua
Un cambiamento di pH da un livello neutro può essere causato dall’aggiunta di sostanze di diverso potere. Ad esempio, se aggiungiamo uno degli acidi più forti ( acido cloridrico, HCl ) all’acqua, causerà la dissociazione dell’acido secondo la seguente reazione:  A differenza dell’auto-dissociazione dell’acqua, l’equilibrio della dissociazione acida è significativamente spostato a destra. Pertanto, se tale acido viene disciolto in acqua ambientalmente inerte, aumenterà la quantità di ioni idronio presenti nell’acqua e, di conseguenza, aumenterà la loro attività molare. Per fare un esempio, secondo la reazione di dissociazione, l’acido cloridrico concentrato a 1 mol/dm 3 introduce nella soluzione ioni idronio concentrati a 1 mol/dm 3 . Il livello di pH per tale soluzione di acido cloridrico può essere calcolato in base alla seguente formula:
A differenza dell’auto-dissociazione dell’acqua, l’equilibrio della dissociazione acida è significativamente spostato a destra. Pertanto, se tale acido viene disciolto in acqua ambientalmente inerte, aumenterà la quantità di ioni idronio presenti nell’acqua e, di conseguenza, aumenterà la loro attività molare. Per fare un esempio, secondo la reazione di dissociazione, l’acido cloridrico concentrato a 1 mol/dm 3 introduce nella soluzione ioni idronio concentrati a 1 mol/dm 3 . Il livello di pH per tale soluzione di acido cloridrico può essere calcolato in base alla seguente formula: 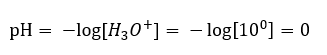
L’aggiunta di una base in acqua
Nell’evento opposto, quando aggiungiamo una base forte all’acqua, la concentrazione di ioni idronio diminuirà. Ad esempio, l’idrossido di sodio concentrato a 1mol/dm 3 avrà, analogamente, la stessa concentrazione ma di altri ioni (ioni idrossido), a seconda della reazione che subisce sotto l’influenza dell’acqua:  In tal caso, è possibile calcolare indirettamente il pH utilizzando la seguente formula pOH supplementare:
In tal caso, è possibile calcolare indirettamente il pH utilizzando la seguente formula pOH supplementare: 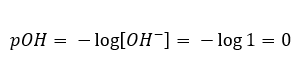 Se sappiamo che:
Se sappiamo che: 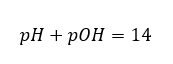 possiamo facilmente calcolare che il pH della soluzione di una base forte (NaOH) concentrata a 1 mol/dm 3 ha un pH di 14.
possiamo facilmente calcolare che il pH della soluzione di una base forte (NaOH) concentrata a 1 mol/dm 3 ha un pH di 14. 
Il livello di pH fuori scala?
Poiché la scala del pH è stata originariamente sviluppata per scopi di soluzioni diluite, è possibile che gli acidi o le basi forti la superino, scendendo sotto 0 o sopra 14. Questo perché la scala è inutile per alte concentrazioni dove il pH non è più un logaritmo funzione degli ioni idronio [H 3 O +]. Quindi usiamo valori diversi, che derivano da equilibri costanti della dissociazione di acidi e basi.
Metodi di determinazione del valore di pH della soluzione
Per determinare empiricamente il pH di un ambiente, utilizziamo i cosiddetti indicatori acido-base. In pratica si tratta di sostanze che cambiano colore se influenzate da diverse condizioni di pH. Esistono tre tipi di tali indicatori:
- Indicatori che cambiano colore in un ambiente di base, ad esempio:
- la fenolftaleina incolore diventa color lampone,
- la timolftaleina incolore diventa blu.
- Indicatori che cambiano colore in un ambiente acido, ad esempio:
- l’arancio metilico cambia colore da arancione a rosso,
- il blu di bromotimolo cambia colore da blu a giallo.
- Indicatori universali, ad esempio:
- il blu di bromotimolo diventa giallo negli acidi e blu nelle basi,
- lacmus diventa rosso negli acidi o blu nelle basi.
È anche comune immergere le cartine di tornasole in una miscela di diverse sostanze indicatrici, che aumenta l’intervallo dei livelli di pH. Inoltre, molti laboratori utilizzano cartine di tornasole universali già pronte che cambiano colore nella gamma dal rosso al verde, suggerendo opportunamente il pH testato sulla base di una scala di accompagnamento. Tale determinazione ci consente di stimare solo il valore del pH con una precisione di 0,5 unità sulla scala del pH. Un metodo più preciso per misurare il valore del pH è la titolazione acido-base, che comprende i sottotipi di alcalimetria (titolazione con una soluzione basica standardizzata) e acidimetria (titolazione con una soluzione acida standardizzata). Utilizza un titolante a concentrazione nota che, reagendo con la sostanza in esame, varia continuamente la concentrazione di ioni idronio presenti nella soluzione. Tale determinazione può essere effettuata in due modi: visivamente, durante la determinazione del punto finale, insieme al viraggio di colore o con l’uso di metodi strumentali, ad esempio potenziometria o conduttometria. Come suggerisce il nome, l’uso di un pHmetro ci permette anche di definire il valore di pH della sostanza. Lo strumento, funzionante in base alla potenziometria, ha una cella in due elettrodi identici. Uno di questi, chiamato elettrodo indicatore, dovrebbe essere inserito nella soluzione testata. L’altro (elettrodo di confronto) viene posto nella soluzione standard con un valore di pH noto. Una sostanza comunemente usata è la soluzione di cloruro d’argento. Entrambi gli elettrodi sono collegati con un voltmetro estremamente sensibile, che converte continuamente l’EMF (forza elettromotrice) in un particolare risultato nella scala del pH. Secondo la teoria di Nernst, la forza elettromotrice (EMF) della cellula, costituita da due elettrodi identici immersi in soluzioni con diversi valori di pH, è direttamente proporzionale al logaritmo del quoziente di entrambe le concentrazioni.
Metodi casalinghi per misurare il valore del pH
Si scopre che ci sono molti indicatori di pH naturali e il valore approssimativo del pH può essere misurato nell’ambiente domestico. Ad esempio, un infuso di foglie di tè nero diventa più brillante se mescolato con un acido, ad esempio il succo di limone. Al contrario, diventa più scuro sotto l’influenza di basi come una soluzione di bicarbonato di sodio. Il succo di cavolo rosso cambia colore dal viola al rosso se sottoposto ad un acido, o al blu se mescolato con una base.

