L'échelle de pH est utilisée pour déterminer le degré d'acidité ou d'alcalinité d'une solution sur une échelle quantitative qui contient les nombres absolus de 0 à 14. Elle est basée sur l'activité molaire des ions hydronium [H 3 O +] dans le liquide testé. L'échelle a été développée en 1909 par le biochimiste danois S. Sorensen, et les lettres 'p' et 'H' représentent, respectivement, le latin 'potentio' (puissance) et l'atome d'hydrogène, qui est noté dans le tableau périodique comme 'H' (hydrogénium). L'échelle de pH reflète à la fois l'un et l'autre : pour déterminer le niveau de pH, nous utilisons l'exposant de puissance avec un signe modifié pour désigner les protons contenant de l'hydrogène. Le niveau de pH de toute solution produite est l'une de ses caractéristiques chimiques les plus importantes et un facteur qui détermine le déroulement et la vitesse de nombreuses réactions chimiques ainsi que le type de substances produites.

Différenciation sur l’échelle
L’échelle de pH comprend quinze degrés, où la valeur médiane (7) indique un pH neutre. Les solutions positionnées près de 0 sont appelées acides forts, tandis que celles du côté opposé, proches de 14, sont appelées bases fortes. Un pH acide signifie que la solution contient trop d’ions hydrogène [H 3 O +], et un pH basique signifie qu’il y a trop d’ions hydroxyde [OH –]. L’échelle de pH est le plus souvent mentionnée dans le contexte des solutions, mais le potentiel chimique absolu d’un proton la rend applicable dans tous les états d’agrégation. Cela nous permet de comparer directement le niveau d’alcalinité de pratiquement n’importe quelle substance.
Auto-dissociation de l’eau
Pour bien comprendre le sens de l’échelle de pH, nous avons besoin de la réaction spontanée d’autodissociation de l’eau, qui se déroule selon l’équation suivante :  C’est un processus réversible dont la constante d’équilibre est déplacée vers la gauche de l’équation, c’est-à-dire vers l’eau non dissociée.
C’est un processus réversible dont la constante d’équilibre est déplacée vers la gauche de l’équation, c’est-à-dire vers l’eau non dissociée.
Comment calculer le niveau de pH?
Malgré l’hypothèse initiale erronée selon laquelle la détermination porte sur la concentration en ions hydrogène [H +], la formule la plus populaire reste la suivante :  Aujourd’hui, nous savons déjà que les solutions aqueuses ne contiennent pas d’ions hydrogène, c’est-à-dire de protons présents dans l’eau, en raison du processus immédiat de solvatation. Le phénomène se traduit par le manque de protons libres et la présence d’ions hydronium [H 3 O +], qui est provoqué par la réaction spontanée et irréversible :
Aujourd’hui, nous savons déjà que les solutions aqueuses ne contiennent pas d’ions hydrogène, c’est-à-dire de protons présents dans l’eau, en raison du processus immédiat de solvatation. Le phénomène se traduit par le manque de protons libres et la présence d’ions hydronium [H 3 O +], qui est provoqué par la réaction spontanée et irréversible : 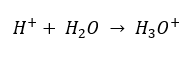 Par conséquent, la notation correcte de la formule est la suivante :
Par conséquent, la notation correcte de la formule est la suivante : 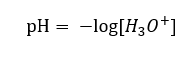
Environnement indiqué sur l’échelle de pH
On suppose que la concentration d’ions hydronium dans l’eau pure à température ambiante (25 o C) est de 10 -7 mol/dm 3 , de sorte que son niveau de pH peut être calculé comme suit : 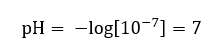 Cela correspond au fait que l’eau, étant neutre, est positionnée au milieu de l’échelle, ce qui indique l’inertie chimique de la substance. Cela prouve également que l’eau contient un nombre égal d’anions hydroxyde et de cations hydronium. Dans les acides et les bases, cependant, cet équilibre est perturbé. Un exposant négatif suggère une relation où plus le niveau de pH est bas, plus la puissance de la solution testée est élevée. Le terme « puissance » dans le contexte de l’échelle de pH fait référence au fait que la valeur 0 est prise par les acides forts, voire irritants, tandis que la valeur 14 fait référence aux substances alcalines les plus fortes.
Cela correspond au fait que l’eau, étant neutre, est positionnée au milieu de l’échelle, ce qui indique l’inertie chimique de la substance. Cela prouve également que l’eau contient un nombre égal d’anions hydroxyde et de cations hydronium. Dans les acides et les bases, cependant, cet équilibre est perturbé. Un exposant négatif suggère une relation où plus le niveau de pH est bas, plus la puissance de la solution testée est élevée. Le terme « puissance » dans le contexte de l’échelle de pH fait référence au fait que la valeur 0 est prise par les acides forts, voire irritants, tandis que la valeur 14 fait référence aux substances alcalines les plus fortes.
L’ajout d’acide dans l’eau
Un changement de pH à partir d’un niveau neutre peut être provoqué par l’ajout de substances de différentes puissances. Par exemple, si nous ajoutons l’un des acides les plus forts ( acide chlorhydrique, HCl ) à l’eau, cela provoquera la dissociation de l’acide selon la réaction suivante :  Contrairement à l’autodissociation de l’eau, l’équilibre de la dissociation acide est significativement décalé vers la droite. Par conséquent, si cet acide est dissous dans de l’eau écologiquement inerte, il augmentera la quantité d’ions hydronium présents dans l’eau et, par conséquent, augmentera leur activité molaire. A titre d’exemple, selon la réaction de dissociation, l’acide chlorhydrique concentré à 1 mol/dm 3 introduit dans la solution des ions hydronium concentrés à 1 mol/dm 3 . Le niveau de pH d’une telle solution d’acide chlorhydrique peut être calculé sur la base de la formule suivante :
Contrairement à l’autodissociation de l’eau, l’équilibre de la dissociation acide est significativement décalé vers la droite. Par conséquent, si cet acide est dissous dans de l’eau écologiquement inerte, il augmentera la quantité d’ions hydronium présents dans l’eau et, par conséquent, augmentera leur activité molaire. A titre d’exemple, selon la réaction de dissociation, l’acide chlorhydrique concentré à 1 mol/dm 3 introduit dans la solution des ions hydronium concentrés à 1 mol/dm 3 . Le niveau de pH d’une telle solution d’acide chlorhydrique peut être calculé sur la base de la formule suivante : 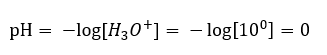
L’ajout d’une base dans l’eau
Dans le cas contraire, où nous ajoutons une base forte dans l’eau, la concentration en ions hydronium chutera. Par exemple, la soude concentrée à 1mol/dm 3 aura, de manière analogue, la même concentration mais d’autres ions (ions hydroxyde), selon la réaction qu’elle subit sous l’influence de l’eau :  Dans un tel cas, il est possible de calculer indirectement le pH en utilisant la formule supplémentaire de pOH suivante :
Dans un tel cas, il est possible de calculer indirectement le pH en utilisant la formule supplémentaire de pOH suivante : 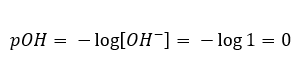 Si nous savons que :
Si nous savons que : 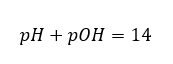 on peut facilement calculer que le pH de la solution d’une base forte (NaOH) concentrée à 1 mol/dm 3 a un pH de 14.
on peut facilement calculer que le pH de la solution d’une base forte (NaOH) concentrée à 1 mol/dm 3 a un pH de 14. 
Le niveau de pH hors de l’échelle?
Comme l’échelle de pH a été développée à l’origine pour les besoins des solutions diluées, il est possible que des acides ou des bases fortes la dépassent, passant en dessous de 0 ou au-dessus de 14. En effet, l’échelle est inutile pour les fortes concentrations où le pH n’est plus un logarithmique. fonction des ions hydronium [H 3 O +]. Ensuite, nous utilisons des valeurs différentes, qui découlent d’équilibres constants de la dissociation des acides et des bases.
Méthodes de détermination du pH de la solution
Pour déterminer empiriquement le pH d’un milieu, on utilise les indicateurs dits acido-basiques. En pratique, ce sont des substances qui changent de couleur lorsqu’elles sont affectées par différentes conditions de pH. Il existe trois types d’indicateurs de ce type :
- Indicateurs qui changent de couleur dans un environnement basique, par exemple :
- la phénolphtaléine incolore devient framboise,
- la thymolphtaléine incolore vire au bleu.
- Indicateurs qui changent de couleur dans un environnement acide, par exemple :
- le méthyl orange change de couleur de l’orange au rouge,
- le bleu de bromothymol change sa couleur du bleu au jaune.
- Indicateurs universels, par exemple :
- le bleu de bromothymol devient jaune dans les acides et bleu dans les bases,
- le lacmus devient rouge dans les acides ou bleu dans les bases.
Il est également courant de faire tremper des papiers de tournesol dans un mélange de différentes substances indicatrices, ce qui augmente la plage des niveaux de pH. De plus, de nombreux laboratoires utilisent des papiers de tournesol universels prêts à l’emploi qui changent de couleur dans la gamme du rouge au vert, suggérant de manière appropriée le pH testé sur la base d’une échelle d’accompagnement. Une telle détermination nous permet d’estimer uniquement la valeur du pH avec une précision de 0,5 unité sur l’échelle de pH. Une méthode plus précise de mesure de la valeur du pH est le titrage acido-basique, qui comprend les sous-types d’alcalimétrie (titrage avec une solution basique standardisée) et d’acidométrie (titrage avec une solution acide standardisée). Il utilise un titrant de concentration connue qui, lorsqu’il réagit avec la substance testée, fait varier en continu la concentration d’ions hydronium présents dans la solution. Une telle détermination peut être effectuée de deux manières : visuellement, lors de la détermination du point final, en même temps que le changement de couleur ou à l’aide de méthodes instrumentales, par exemple la potentiométrie ou la conductométrie. Comme son nom l’indique, l’utilisation d’un pH-mètre permet également de définir le pH de la substance. L’instrument, fonctionnant par potentiométrie, possède une cellule à deux électrodes identiques. L’une d’elles, appelée électrode indicatrice, doit être placée dans la solution testée. L’autre (électrode comparative) est placée dans la solution standard avec une valeur de pH connue. Une substance couramment utilisée est la solution de chlorure d’argent. Les deux électrodes sont connectées à un voltmètre extrêmement sensible, qui convertit en continu l’EMF (force électromotrice) en un résultat particulier dans l’échelle de pH. Selon la théorie de Nernst, la force électromotrice (FEM) de la cellule, constituée de deux électrodes identiques immergées dans des solutions de pH différents, est directement proportionnelle au logarithme du quotient des deux concentrations.
Méthodes domestiques de mesure de la valeur du pH
Il s’avère qu’il existe de nombreux indicateurs de pH naturels et que la valeur approximative du pH peut être mesurée dans l’environnement domestique. Par exemple, une infusion à base de feuilles de thé noir devient plus brillante lorsqu’elle est mélangée à un acide, par exemple du jus de citron. A l’inverse, il s’assombrit sous l’influence de bases telles qu’une solution de bicarbonate de soude. Le jus de chou rouge change de couleur du violet au rouge lorsqu’il est soumis à un acide, ou au bleu lorsqu’il est mélangé à une base.

