Stupnica pH sa používa na určenie stupňa kyslosti alebo zásaditosti roztoku na kvantitatívnej stupnici, ktorá obsahuje absolútne čísla od 0 do 14. Je založená na molárnej aktivite hydróniových iónov [H 3 O +] v testovanej kvapaline. Stupnicu vyvinul v roku 1909 dánsky biochemik S. Sorensen a písmená „p“ a „H“ znamenajú latinské „potentio“ (sila) a atóm vodíka, ktorý je označený v periodickej tabuľke. ako „H“ (vodík). Stupnica pH odráža jedno aj druhé: na určenie úrovne pH používame mocninový exponent so zmeneným znamienkom, ktorý odkazuje na protóny obsahujúce vodík. Úroveň pH akéhokoľvek vyrobeného roztoku je jednou z jeho najdôležitejších chemických vlastností a faktorom, ktorý určuje priebeh a rýchlosť mnohých chemických reakcií, ako aj typ vyrobených látok.

Diferenciácia na stupnici
Stupnica pH zahŕňa pätnásť stupňov, pričom stredná hodnota (7) označuje neutrálne pH. Roztoky umiestnené blízko 0 sa nazývajú silné kyseliny, zatiaľ čo tie na opačnej strane, blízko 14, sa označujú ako silné zásady. Kyslé pH znamená, že roztok obsahuje príliš veľa vodíkových iónov [H 3 O +], a zásadité pH znamená, že je v ňom príliš veľa hydroxidových iónov [OH –]. Stupnica pH sa najčastejšie uvádza v súvislosti s roztokmi, ale absolútny chemický potenciál protónu ju robí použiteľnou vo všetkých stavoch agregácie. To nám umožňuje priamo porovnávať úroveň zásaditosti prakticky akejkoľvek látky.
Samovoľná disociácia vody
Aby sme plne pochopili zmysel stupnice pH, potrebujeme spontánnu reakciu samodisociácie vody, ktorá prebieha podľa nasledujúcej rovnice:  Ide o reverzibilný proces, ktorého rovnovážna konštanta je posunutá na ľavú stranu rovnice, teda smerom k nedisociovanej vode.
Ide o reverzibilný proces, ktorého rovnovážna konštanta je posunutá na ľavú stranu rovnice, teda smerom k nedisociovanej vode.
Ako vypočítať hladinu pH?
Napriek chybne definovanému počiatočnému predpokladu, že stanovenie sa týka koncentrácie vodíkových iónov [H +], najobľúbenejší vzorec je stále nasledujúci:  Dnes už vieme, že roztoky neobsahujú vodné vodíkové ióny, teda protóny prítomné vo vode, vďaka okamžitému procesu solvatácie. Tento jav má za následok nedostatok voľných protónov a prítomnosť hydróniových iónov [H 3 O +], čo je spôsobené spontánnou, ireverzibilnou reakciou:
Dnes už vieme, že roztoky neobsahujú vodné vodíkové ióny, teda protóny prítomné vo vode, vďaka okamžitému procesu solvatácie. Tento jav má za následok nedostatok voľných protónov a prítomnosť hydróniových iónov [H 3 O +], čo je spôsobené spontánnou, ireverzibilnou reakciou: 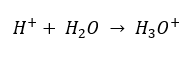 Správny zápis vzorca je teda takýto:
Správny zápis vzorca je teda takýto: 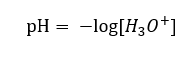
Prostredie označené na stupnici pH
Predpokladá sa, že koncentrácia hydróniových iónov v čistej vode pri izbovej teplote (25 o C) je 10 -7 mol/dm 3 , takže jej úroveň pH možno vypočítať nasledovne: 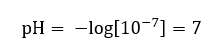 To je v súlade so skutočnosťou, že voda je neutrálna a je umiestnená v strede stupnice, čo naznačuje chemickú inertnosť látky. Dokazuje tiež, že voda obsahuje rovnaký počet hydroxidových aniónov a hydróniových katiónov. V kyselinách a zásadách je však táto rovnováha narušená. Záporný exponent naznačuje vzťah, kde čím nižšia je hodnota pH, tým vyššia je sila testovaného roztoku. Pojem „sila“ v kontexte stupnice pH odkazuje na skutočnosť, že hodnotu 0 majú silné, dokonca dráždivé kyseliny, kým hodnota 14 označuje najsilnejšie alkalické látky.
To je v súlade so skutočnosťou, že voda je neutrálna a je umiestnená v strede stupnice, čo naznačuje chemickú inertnosť látky. Dokazuje tiež, že voda obsahuje rovnaký počet hydroxidových aniónov a hydróniových katiónov. V kyselinách a zásadách je však táto rovnováha narušená. Záporný exponent naznačuje vzťah, kde čím nižšia je hodnota pH, tým vyššia je sila testovaného roztoku. Pojem „sila“ v kontexte stupnice pH odkazuje na skutočnosť, že hodnotu 0 majú silné, dokonca dráždivé kyseliny, kým hodnota 14 označuje najsilnejšie alkalické látky.
Pridanie kyseliny do vody
Zmena pH z neutrálnej úrovne môže byť spôsobená pridaním látok rôznej sily. Napríklad, ak do vody pridáme jednu z najsilnejších kyselín ( kyselinu chlorovodíkovú, HCl ), spôsobí to disociáciu kyseliny podľa nasledujúcej reakcie:  Na rozdiel od samodisociácie vody je rovnováha kyslej disociácie výrazne posunutá doprava. Preto, ak je táto kyselina rozpustená v environmentálne inertnej vode, zvýši sa množstvo hydróniových iónov prítomných vo vode a v dôsledku toho sa zvýši ich molárna aktivita. Aby sme uviedli príklad, podľa disociačnej reakcie, kyselina chlorovodíková koncentrovaná pri 1 mol/ dm3 zavádza do roztoku hydróniové ióny koncentrované pri 1 mol/ dm3 . Úroveň pH pre takýto roztok kyseliny chlorovodíkovej možno vypočítať na základe nasledujúceho vzorca:
Na rozdiel od samodisociácie vody je rovnováha kyslej disociácie výrazne posunutá doprava. Preto, ak je táto kyselina rozpustená v environmentálne inertnej vode, zvýši sa množstvo hydróniových iónov prítomných vo vode a v dôsledku toho sa zvýši ich molárna aktivita. Aby sme uviedli príklad, podľa disociačnej reakcie, kyselina chlorovodíková koncentrovaná pri 1 mol/ dm3 zavádza do roztoku hydróniové ióny koncentrované pri 1 mol/ dm3 . Úroveň pH pre takýto roztok kyseliny chlorovodíkovej možno vypočítať na základe nasledujúceho vzorca: 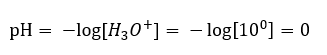
Pridanie zásady do vody
V opačnom prípade, keď do vody pridáme silnú zásadu, koncentrácia hydróniových iónov klesne. Napríklad hydroxid sodný koncentrovaný na 1 mol/dm 3 bude mať analogicky rovnakú koncentráciu, ale iných iónov (hydroxidových iónov), podľa reakcie, ktorú pod vplyvom vody podstúpi:  V takom prípade je možné nepriamo vypočítať pH pomocou nasledujúceho doplnkového vzorca pOH:
V takom prípade je možné nepriamo vypočítať pH pomocou nasledujúceho doplnkového vzorca pOH: 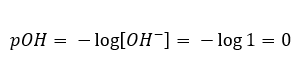 Ak vieme, že:
Ak vieme, že: 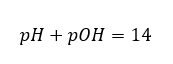 ľahko vypočítame, že pH roztoku silnej zásady (NaOH) koncentrovaného na 1 mol/dm 3 má pH 14.
ľahko vypočítame, že pH roztoku silnej zásady (NaOH) koncentrovaného na 1 mol/dm 3 má pH 14. 
Úroveň pH mimo váhy?
Keďže stupnica pH bola pôvodne vyvinutá pre účely zriedených roztokov, je možné, že silné kyseliny alebo zásady ju prekročia, a to pod 0 alebo nad 14. Je to preto, že stupnica je zbytočná pre vysoké koncentrácie, kde pH už nie je logaritmické. funkcia hydróniových iónov [H 3 O +]. Vtedy používame rôzne hodnoty, ktoré vznikajú konštantnými rovnováhami disociácie kyselín a zásad.
Metódy stanovenia hodnoty pH roztoku
Na empirické stanovenie pH prostredia používame takzvané acidobázické indikátory. V praxi sú to látky, ktoré pri ovplyvnení rôznymi podmienkami pH menia svoju farbu. Existujú tri typy takýchto ukazovateľov:
- Indikátory, ktoré menia svoju farbu v základnom prostredí, napríklad:
- bezfarebný fenolftaleín má malinovú farbu,
- bezfarebný tymolftaleín sa zmení na modrý.
- Indikátory, ktoré menia svoju farbu v kyslom prostredí, napríklad:
- metyloranž mení svoju farbu z oranžovej na červenú,
- brómtymolová modrá mení svoju farbu z modrej na žltú.
- Univerzálne ukazovatele, napr.
- brómtymolová modrá sa mení na žltú v kyselinách a na modrú v zásadách,
- lakmus sa v kyselinách sfarbuje do červena alebo v zásadách do modra.
Bežné je aj namáčanie lakmusových papierikov do zmesi rôznych indikátorových látok, čo zvyšuje rozsah hodnôt pH. Okrem toho mnohé laboratóriá používajú hotové, univerzálne lakmusové papieriky, ktoré menia farby v rozsahu od červenej po zelenú, pričom vhodne naznačujú testované pH na základe sprievodnej stupnice. Takéto stanovenie nám umožňuje odhadnúť iba hodnotu pH s presnosťou 0,5 jednotky na stupnici pH. Presnejšou metódou merania hodnoty pH je acidobázická titrácia, ktorá zahŕňa podtypy alkalimetrie (titrácia štandardizovaným zásaditým roztokom) a acidimetria (titrácia štandardizovaným roztokom kyseliny). Používa titrant so známou koncentráciou, ktorý pri reakcii s testovanou látkou kontinuálne mení koncentráciu hydróniových iónov prítomných v roztoku. Takéto stanovenie sa môže uskutočniť dvoma spôsobmi: vizuálne, pri určovaní koncového bodu spolu so zmenou farby alebo s použitím inštrumentálnych metód, napríklad potenciometrie alebo konduktometrie. Ako už názov napovedá, použitie pH metra nám tiež umožňuje definovať hodnotu pH látky. Prístroj fungujúci na základe potenciometrie má článok v dvoch rovnakých elektródach. Jeden z nich, nazývaný indikačná elektróda, by sa mal vložiť do testovaného roztoku. Druhá (porovnávacia elektróda) sa umiestni do štandardného roztoku so známou hodnotou pH. Bežne používanou látkou je roztok chloridu strieborného. Obe elektródy sú spojené s mimoriadne citlivým voltmetrom, ktorý nepretržite premieňa EMF (elektromotorickú silu) na konkrétny výsledok v stupnici pH. Podľa Nernstovej teórie je elektromotorická sila článku (EMF), pozostávajúca z dvoch identických elektród ponorených do roztokov s rôznymi hodnotami pH, priamo úmerná logaritmu kvocientu oboch koncentrácií.
Domáce metódy merania hodnoty pH
Ukazuje sa, že existuje veľa prirodzených indikátorov pH a približná hodnota pH sa dá merať v domácom prostredí. Napríklad nálev z lístkov čierneho čaju sa rozjasní, keď sa zmieša s kyselinou, napr. citrónovou šťavou. Naopak, tmavne pod vplyvom zásad, ako je roztok sódy bikarbóny. Šťava z červenej kapusty mení svoju farbu z fialovej na červenú, keď je vystavená kyseline, alebo na modrú, keď je zmiešaná so zásadou.

