Der pH-Wert wird zur Bestimmung des Säure- oder Alkalitätsgrades einer Lösung auf einer quantitativen Skala verwendet, die absolute Zahlen von 0 bis 14 enthält und auf der molaren Aktivität von Hydroniumionen [H3O+] in der zu prüfenden Flüssigkeit basiert. Der pH-Wert wurde 1909 von dem dänischen Biochemiker S. Sorensen entwickelt, und die Buchstaben "p" und "H" im Namen stehen für das lateinische Wort potentio - Potenz und das Wasserstoffatom, das in der Tabelle des Periodensystems der Elemente als H (hydrogenium) geschrieben wird. Der pH-Wert spiegelt beides wider: zur Bestimmung der Reaktion wird der Exponent einer Potenz mit umgekehrtem Vorzeichen verwendet, und die Referenz sind die wasserstoffhaltigen Protonen. Der pH-Wert einer Lösung ist ein wichtiges chemisches Merkmal und ein Faktor, der den Verlauf und die Geschwindigkeit vieler chemischer Reaktionen sowie die Art der dabei entstehenden Produkte bestimmt.
Der pH-Wert ist in fünfzehn Stufen eingeteilt, wobei der mittlere Wert - 7 - eine neutrale, inerte Reaktion anzeigt. Lösungen im Bereich um 0 werden als starke Säuren bezeichnet, während Lösungen auf der gegenüberliegenden Seite, im Bereich um 14, als starke Basen bezeichnet werden. Eine saure Reaktion weist auf einen Überschuss an Wasserstoffionen [H3O+] in der Lösung hin, während eine alkalische Reaktion auf einen Überschuss an Hydroxylionen [OH-] hinweist. Der pH-Wert wird am häufigsten im Zusammenhang mit Lösungen genannt, aber aufgrund des absoluten chemischen Potenzials eines Protons kann er auf alle Aggregatzustände angewendet werden. So ermöglicht es den direkten Vergleich des Alkalitätsgrades praktisch aller Substanzen.
Um die Bedeutung der pH-Skala vollständig zu verstehen, ist die spontane Autodissoziationsreaktion von Wasser unerlässlich, die der Gleichung folgt:

Es ist ein reversibler Prozess, dessen Gleichgewichtskonstante auf die linke Seite der Gleichung verschoben wird, d.h. in Richtung undissoziiertes Wasser.
Trotz der anfänglich falsch definierten Annahme, dass die Wasserstoffionenkonzentration [H+] bestimmt wird, lautet die am häufigsten verwendete Formel immer noch:

Heute weiß man jedoch, dass Lösungen aufgrund des sofortigen Solvatisierungsprozesses überhaupt keine freien Wasserstoffionen, d.h. die in der Formel vorhandenen Protonen, enthalten. Das Phänomen führt zum Fehlen freier Protonen zugunsten der Anwesenheit von Hydroniumionen [H3O+], was auf eine spontane, irreversible Reaktion zurückzuführen ist:
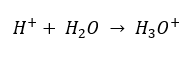
Die korrekte Schreibweise der Formel lautet daher
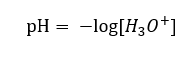
Es wird davon ausgegangen, dass die Konzentration von Hydroniumionen in sauberem Wasser bei einer Raumtemperatur von 25oC gleich 10-7 mol/dm3 ist, so dass der pH-Wert wie folgt berechnet werden kann:
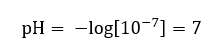
Dies steht im Einklang mit der Tatsache, dass Wasser als neutrale Substanz in der Mitte der Skala liegt, was auf die Neutralität der Reaktion der Substanz hinweist. Das bedeutet auch, dass Wasser zu gleichen Teilen Hydroxylanionen und Hydroniumkationen enthält. Bei Säuren und Basen ist dieses Gleichgewicht jedoch gestört. Der negative Exponent der Potenz legt die Beziehung nahe, dass die Potenz der zu prüfenden Lösung umso größer ist, je kleiner der pH-Wert ist. Der Begriff "Stärke" im Falle des pH-Wertes bezieht sich auf die Tatsache, dass ein Wert von 0 für starke, sogar ätzende Säuren steht, während ein Wert von 14 für die stärksten alkalischen Reaktionen steht.
Eine Änderung des pH-Wertes einer neutralen Reaktion kann durch die Zugabe von Substanzen unterschiedlicher Stärke herbeigeführt werden. So führt beispielsweise die Zugabe einer der stärksten Säuren, der Salzsäure HCl, zu Wasser zu deren Dissoziation, entsprechend der Reaktion:

Das Gleichgewicht der Säuredissoziationsreaktion ist, im Gegensatz zur Autodissoziation von Wasser, stark nach rechts, zu den Produkten, verschoben. Dies hat zur Folge, dass sich beim Lösen dieser Säure in inertem Wasser die Menge der im Wasser vorhandenen Hydroniumionen erhöht und somit deren molare Aktivität zunimmt. Zum Beispiel führt Salzsäure mit einer Konzentration von 1 mol/dm3 gemäß der Dissoziationsreaktion Hydroniumionen mit einer Konzentration von 1 mol/dm3 in die Lösung ein. Der pH-Wert einer solchen Salzsäurelösung lässt sich anhand der Formel berechnen:
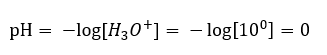
Im umgekehrten Fall, der Zugabe einer starken Base zu Wasser, nimmt die Konzentration der Hydroniumionen ab. Natriumhydroxid mit einer Konzentration von 1mol/dm3 hat beispielsweise die gleiche Konzentration, aber von anderen Ionen, nämlich Hydroniumionen, gemäß der Reaktion, die es bei Kontakt mit Wasser eingeht:

In diesem Fall ist es möglich, den pH-Wert indirekt zu berechnen, indem man die ergänzende Formel für pOH verwendet:
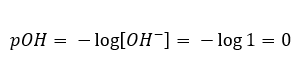
Wissend, dass:
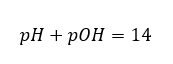
ist es leicht zu berechnen, dass der pH-Wert einer Lösung einer starken Base, NaOH, mit einer Konzentration von 1mol/dm3 einen pH-Wert von 14 hat.

Da der pH-Wert ursprünglich für verdünnte Lösungen entwickelt wurde, ist es möglich, dass starke Säuren oder Basen ihn überschreiten, d.h. unter 0 oder über 14. Dies liegt daran, dass der Wert bei hohen Konzentrationen nicht funktioniert, da die Reaktion nicht mehr eine logarithmische Funktion der Hydroniumionenkonzentration [H3O+] ist. Dann werden andere Werte verwendet, die von den Gleichgewichtskonstanten der Autodissoziation von Säuren und Basen abgeleitet sind.
Für die empirische Bestimmung des pH-Wertes der Umwelt werden so genannte alkazimetrische Indikatoren verwendet. In der Praxis handelt es sich um Substanzen, die unter dem Einfluss unterschiedlicher pH-Bedingungen ihre Farbe ändern. Es gibt drei Arten von solchen Indikatoren:
Es ist auch häufig praktiziert, Lackmuspapiere in einer Mischung verschiedener Indikatorsubstanzen zu tränken, wodurch der Bereich der pH-Liste erweitert wird. Darüber hinaus werden in den Labors häufig fertige Universalindikatorpapiere verwendet, die sich z.B. von rot bis grün einfärben und anhand der darauf angebrachten Skala einen korrekt geprüften pH-Wert anzeigen. Eine solche Anzeige erlaubt nur eine Schätzung des pH-Wertes mit einer Genauigkeit von 0,5 Einheiten des pH-Wertes.
Eine genauere Methode zur Messung des pH-Werts ist die alkalimetrische Titration mit den Unterarten Alkalimetrie (Titration mit einer Maßlösung der Lauge) und Acidimetrie (Titration mit einer Maßlösung der Säure). Dabei wird ein Titriermittel mit bekannter Konzentration verwendet, das durch Reaktion mit der zu prüfenden Substanz die noch in der Lösung vorhandene Hydroniumionenkonzentration verändert. Eine solche Bestimmung kann auf zwei Arten erfolgen - mit einem visuell bestimmten Endpunkt, mit einer Farbänderung, oder mit instrumentellen Methoden, zum Beispiel potentiometrisch oder konduktometrisch.
Mit einem pH-Meter kann man, wie der Name schon sagt, auch die Reaktion einer Substanz bestimmen. Das Gerät, das nach dem Prinzip der Potentiometrie funktioniert, besteht aus einer Zelle mit zwei identischen Elektroden. Eine dieser Elektroden, die so genannte Indikatorelektrode, muss in die Testlösung getaucht werden. Die andere, die Vergleichselektrode, wird in eine Musterlösung mit bekanntem pH-Wert getaucht. Häufig wird eine Silberchloridlösung verwendet. Diese Elektroden sind mit einem sehr empfindlichen Voltmeter verbunden, das das SEM, d.h. den Messwert der elektromotorischen Kraft, in ein konkretes Ergebnis im pH-Wert umrechnet. Nach der Theorie von Nernst ist die elektromotorische Kraft einer Zelle (SEM), die aus zwei identischen Elektroden besteht, die in unterschiedlich reagierende Lösungen getaucht sind, direkt proportional zum Logarithmus des Quotienten dieser Konzentrationen.
Es stellt sich heraus, dass es viele natürliche pH-Indikatoren gibt, und wir können den ungefähren pH-Wert zu Hause messen. Zum Beispiel wird ein Aufguss aus schwarzen Teeblättern heller, wenn eine Säure, wie Zitronensaft, hinzugefügt wird. Dieser Aufguss hingegen verdunkelt sich unter dem Einfluss von Alkalien, wie z. B. einer Lösung von Natron. Der Saft von Rotkohl färbt sich in Gegenwart einer Säure von violett zu rot, und bei Zugabe einer Lauge wird er blau.

Finden Sie Ihren Platz in der PCC-Gruppe. Informieren Sie sich über unser Angebot und wachsen Sie mit uns.
Ein unbezahltes Sommerpraktikumsprogramm für Studenten und Hochschulabsolventen aller Fachrichtungen.