Stupnice pH se používá k určení stupně kyselosti nebo zásaditosti roztoku na kvantitativní stupnici, která obsahuje absolutní čísla od 0 do 14. Je založena na molární aktivitě hydroniových iontů [H 3 O +] v testované kapalině. Stupnici vyvinul v roce 1909 dánský biochemik S. Sorensen a písmena „p“ a „H“ znamenají latinské „potentio“ (síla) a atom vodíku, který je označen v periodické tabulce. jako 'H' (hydrogenium). Stupnice pH odráží jedno i druhé: k určení úrovně pH používáme mocninný exponent se změněným znaménkem k odkazu na protony obsahující vodík. Úroveň pH každého vyrobeného roztoku je jednou z jeho nejdůležitějších chemických vlastností a faktorem, který určuje průběh a rychlost mnoha chemických reakcí a také typ produkovaných látek.

Diferenciace na stupnici
Stupnice pH zahrnuje patnáct stupňů, kde střední hodnota (7) označuje neutrální pH. Roztoky umístěné blízko 0 se nazývají silné kyseliny, zatímco roztoky na opačné straně, blízko 14, jsou označovány jako silné zásady. Kyselé pH znamená, že roztok obsahuje příliš mnoho vodíkových iontů [H 3 O +], a zásadité pH znamená, že existuje příliš mnoho hydroxidových iontů [OH –]. Stupnice pH je nejčastěji uváděna v souvislosti s roztoky, ale absolutní chemický potenciál protonu ji činí použitelnou ve všech stavech agregace. To nám umožňuje přímo porovnávat úroveň alkality prakticky jakékoli látky.
Samodisociace vody
Abychom plně pochopili smysl pH stupnice, potřebujeme spontánní reakci samodisociace vody, která probíhá podle následující rovnice:  Jde o reverzibilní děj, jehož rovnovážná konstanta je posunuta na levou stranu rovnice, tedy směrem k nedisociované vodě.
Jde o reverzibilní děj, jehož rovnovážná konstanta je posunuta na levou stranu rovnice, tedy směrem k nedisociované vodě.
Jak vypočítat hladinu pH?
Navzdory chybně definovanému počátečnímu předpokladu, že se stanovení týká koncentrace vodíkových iontů [H +], je stále nejoblíbenější vzorec následující:  Dnes již víme, že roztoky neobsahují vodné vodíkové ionty, tedy protony přítomné ve vodě, díky okamžitému procesu solvatace. Tento jev má za následek nedostatek volných protonů a přítomnost hydroniových iontů [H 3 O +], což je způsobeno spontánní, nevratnou reakcí:
Dnes již víme, že roztoky neobsahují vodné vodíkové ionty, tedy protony přítomné ve vodě, díky okamžitému procesu solvatace. Tento jev má za následek nedostatek volných protonů a přítomnost hydroniových iontů [H 3 O +], což je způsobeno spontánní, nevratnou reakcí: 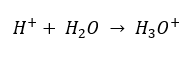 Správný zápis vzorce je tedy následující:
Správný zápis vzorce je tedy následující: 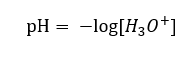
Prostředí označené na stupnici pH
Předpokládá se, že koncentrace hydroniových iontů v čisté vodě při pokojové teplotě (25 o C) je 10 -7 mol/dm 3 , takže její hladinu pH lze vypočítat následovně: 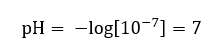 To je v souladu se skutečností, že voda je neutrální a je umístěna uprostřed stupnice, což ukazuje na chemickou inertnost látky. Dokazuje také, že voda obsahuje stejný počet hydroxidových aniontů a hydroniových kationtů. V kyselinách a zásadách je však tato rovnováha narušena. Záporný exponent naznačuje vztah, kdy čím nižší hodnota pH, tím vyšší je síla testovaného roztoku. Pojem „síla“ v kontextu stupnice pH odkazuje na skutečnost, že hodnotu 0 mají silné, dokonce i dráždivé kyseliny, zatímco hodnota 14 označuje nejsilnější alkalické látky.
To je v souladu se skutečností, že voda je neutrální a je umístěna uprostřed stupnice, což ukazuje na chemickou inertnost látky. Dokazuje také, že voda obsahuje stejný počet hydroxidových aniontů a hydroniových kationtů. V kyselinách a zásadách je však tato rovnováha narušena. Záporný exponent naznačuje vztah, kdy čím nižší hodnota pH, tím vyšší je síla testovaného roztoku. Pojem „síla“ v kontextu stupnice pH odkazuje na skutečnost, že hodnotu 0 mají silné, dokonce i dráždivé kyseliny, zatímco hodnota 14 označuje nejsilnější alkalické látky.
Přidání kyseliny do vody
Změna pH z neutrální úrovně může být způsobena přidáním látek různé síly. Pokud například přidáme do vody jednu z nejsilnějších kyselin ( kyselinu chlorovodíkovou, HCl ), způsobí to disociaci kyseliny podle následující reakce:  Na rozdíl od samodisociace vody je rovnováha kyselé disociace výrazně posunuta doprava. Pokud je tedy tato kyselina rozpuštěna v ekologicky inertní vodě, zvýší se množství hydroniových iontů přítomných ve vodě a v důsledku toho se zvýší jejich molární aktivita. Abychom uvedli příklad, podle disociační reakce, kyselina chlorovodíková koncentrovaná na 1 mol/dm 3 zavádí do roztoku hydroniové ionty koncentrované na 1 mol/dm 3 . Úroveň pH pro takový roztok kyseliny chlorovodíkové lze vypočítat na základě následujícího vzorce:
Na rozdíl od samodisociace vody je rovnováha kyselé disociace výrazně posunuta doprava. Pokud je tedy tato kyselina rozpuštěna v ekologicky inertní vodě, zvýší se množství hydroniových iontů přítomných ve vodě a v důsledku toho se zvýší jejich molární aktivita. Abychom uvedli příklad, podle disociační reakce, kyselina chlorovodíková koncentrovaná na 1 mol/dm 3 zavádí do roztoku hydroniové ionty koncentrované na 1 mol/dm 3 . Úroveň pH pro takový roztok kyseliny chlorovodíkové lze vypočítat na základě následujícího vzorce: 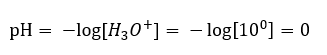
Přidání báze do vody
V opačném případě, kdy do vody přidáme silnou zásadu, koncentrace hydroniových iontů klesne. Například hydroxid sodný koncentrovaný na 1 mol/dm 3 bude mít analogicky stejnou koncentraci, ale jiných iontů (hydroxidových iontů), podle reakce, kterou podstupuje vlivem vody:  V takovém případě je možné nepřímo vypočítat pH pomocí následujícího doplňkového vzorce pOH:
V takovém případě je možné nepřímo vypočítat pH pomocí následujícího doplňkového vzorce pOH: 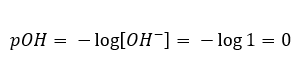 Pokud víme, že:
Pokud víme, že: 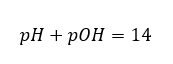 snadno spočítáme, že pH roztoku silné zásady (NaOH) koncentrované na 1 mol/dm 3 má pH 14.
snadno spočítáme, že pH roztoku silné zásady (NaOH) koncentrované na 1 mol/dm 3 má pH 14. 
Úroveň pH mimo stupnici?
Vzhledem k tomu, že stupnice pH byla původně vyvinuta pro účely zředěných roztoků, je možné, že ji silné kyseliny nebo zásady překročí, a to pod 0 nebo nad 14. Je to proto, že stupnice je nepoužitelná pro vysoké koncentrace, kde pH již není logaritmické. funkce hydroniových iontů [H 3 O +]. Pak používáme různé hodnoty, které vznikají konstantními rovnováhami disociace kyselin a zásad.
Metody stanovení hodnoty pH roztoku
K empirickému stanovení pH prostředí používáme tzv. acidobazické indikátory. V praxi se jedná o látky, které při ovlivnění různými podmínkami pH mění svou barvu. Existují tři typy takových indikátorů:
- Indikátory, které mění svou barvu v základním prostředí, například:
- bezbarvý fenolftalein se zbarví do malin,
- bezbarvý thymolftalein zmodrá.
- Indikátory, které mění svou barvu v kyselém prostředí, například:
- methyloranž mění svou barvu z oranžové na červenou,
- bromthymolová modř mění svou barvu z modré na žlutou.
- Univerzální indikátory, např.
- bromthymolová modř se v kyselinách mění na žlutou a v zásadách na modrou,
- lakmus se barví do červena v kyselinách nebo do modra v zásadách.
Je také běžné namáčet lakmusové papírky do směsi různých indikátorových látek, což zvyšuje rozsah hodnot pH. Mnoho laboratoří navíc používá hotové, univerzální lakmusové papírky, které mění barvy v rozsahu od červené po zelenou, což vhodně naznačuje testované pH na základě doprovodné stupnice. Takové stanovení nám umožňuje odhadnout pouze hodnotu pH s přesností na 0,5 jednotky na stupnici pH. Přesnější metodou měření hodnoty pH je acidobazická titrace, která zahrnuje podtypy alkalimetrie (titrace standardizovaným roztokem báze) a acidimetrie (titrace standardizovaným roztokem kyseliny). Využívá titrační činidlo o známé koncentraci, které při reakci s testovanou látkou plynule mění koncentraci hydroniových iontů přítomných v roztoku. Takové stanovení může být provedeno dvěma způsoby: vizuálně, při stanovení koncového bodu, spolu se změnou barvy nebo s použitím instrumentálních metod, například potenciometrie nebo konduktometrie. Jak již název napovídá, použití pH metru nám také umožňuje definovat hodnotu pH látky. Přístroj, pracující na základě potenciometrie, má článek ve dvou stejných elektrodách. Jedna z nich, nazývaná indikační elektroda, by měla být vložena do testovaného roztoku. Druhá (srovnávací elektroda) se umístí do standardního roztoku se známou hodnotou pH. Běžně používanou látkou je roztok chloridu stříbrného. Obě elektrody jsou spojeny s extrémně citlivým voltmetrem, který nepřetržitě převádí EMF (elektromotorickou sílu) na konkrétní výsledek na stupnici pH. Podle Nernstovy teorie je elektromotorická síla článku (EMF), sestávající ze dvou identických elektrod ponořených do roztoků s různými hodnotami pH, přímo úměrná logaritmu podílu obou koncentrací.
Domácí metody měření hodnoty pH
Ukazuje se, že existuje mnoho přirozených indikátorů pH a přibližnou hodnotu pH lze měřit v domácím prostředí. Například nálev z lístků černého čaje se zesvětlí, když se smíchá s kyselinou, např. citronovou šťávou. Naopak tmavne pod vlivem zásad, jako je roztok jedlé sody. Šťáva z červeného zelí mění svou barvu z fialové na červenou, když je vystavena kyselině, nebo na modrou, když je smíchána se zásadou.

