La escala de pH se utiliza para determinar el grado de acidez o alcalinidad de una solución en una escala cuantitativa que contiene los números absolutos del 0 al 14. Se basa en la actividad molar de los iones hidronio [H 3 O +] en el líquido probado. La escala fue desarrollada en 1909 por el bioquímico danés S. Sorensen, y las letras 'p' y 'H' representan, respectivamente, el latín 'potentio' (potencia) y el átomo de hidrógeno, que se indica en la tabla periódica. como 'H' (hidrogenio). La escala de pH refleja tanto lo uno como lo otro: para determinar el nivel de pH, usamos el exponente de potencia con un signo cambiado para referirnos a los protones que contienen hidrógeno. El nivel de pH de cualquier solución producida es una de sus características químicas más importantes y un factor que determina el curso y la velocidad de muchas reacciones químicas, así como el tipo de sustancias producidas.

Diferenciación en la escala
La escala de pH incluye quince grados, donde el valor medio (7) indica un pH neutro. Las soluciones situadas cerca del 0 se denominan ácidos fuertes, mientras que las del lado opuesto, cercanas al 14, se denominan bases fuertes. Un pH ácido significa que la solución contiene demasiados iones de hidrógeno [H 3 O +], y un pH básico significa que hay demasiados iones de hidróxido [OH –]. La escala de pH se menciona con mayor frecuencia en el contexto de las soluciones, pero el potencial químico absoluto de un protón lo hace aplicable en todos los estados de agregación. Esto nos permite comparar directamente el nivel de alcalinidad de prácticamente cualquier sustancia.
Autodisociación del agua
Para comprender completamente el sentido de la escala de pH, necesitamos la reacción espontánea de autodisociación del agua, que procede de acuerdo con la siguiente ecuación:  Es un proceso reversible cuya constante de equilibrio se desplaza hacia el lado izquierdo de la ecuación, es decir, hacia el agua no disociada.
Es un proceso reversible cuya constante de equilibrio se desplaza hacia el lado izquierdo de la ecuación, es decir, hacia el agua no disociada.
¿Cómo calcular el nivel de pH?
A pesar de la suposición inicial erróneamente definida de que la determinación se refiere a la concentración de iones de hidrógeno [H +], la fórmula más popular sigue siendo la siguiente:  Hoy ya sabemos que las soluciones no contienen iones de hidrógeno acuosos, es decir, protones presentes en el agua, debido al proceso inmediato de solvatación. El fenómeno da como resultado la falta de protones libres y la presencia de iones hidronio [H 3 O +], que es causado por la reacción espontánea e irreversible:
Hoy ya sabemos que las soluciones no contienen iones de hidrógeno acuosos, es decir, protones presentes en el agua, debido al proceso inmediato de solvatación. El fenómeno da como resultado la falta de protones libres y la presencia de iones hidronio [H 3 O +], que es causado por la reacción espontánea e irreversible: 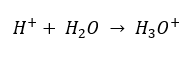 Por lo tanto, la notación correcta de la fórmula es la siguiente:
Por lo tanto, la notación correcta de la fórmula es la siguiente: 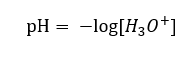
Ambiente indicado en la escala de pH
Se supone que la concentración de iones hidronio en agua pura a temperatura ambiente (25 o C) es de 10 -7 mol/dm 3 , por lo que su nivel de pH se puede calcular de la siguiente manera: 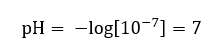 Esto está en consonancia con el hecho de que el agua, al ser neutra, se coloca en el medio de la escala, lo que indica la inercia química de la sustancia. También prueba que el agua contiene un número igual de aniones de hidróxido y cationes de hidronio. En ácidos y bases, sin embargo, ese equilibrio se altera. Un exponente negativo sugiere una relación donde cuanto menor sea el nivel de pH, mayor será el poder de la solución probada. El término ‘potencia’ en el contexto de la escala de pH se refiere al hecho de que el valor 0 lo toman ácidos fuertes, incluso irritantes, mientras que el valor 14 se refiere a las sustancias alcalinas más fuertes.
Esto está en consonancia con el hecho de que el agua, al ser neutra, se coloca en el medio de la escala, lo que indica la inercia química de la sustancia. También prueba que el agua contiene un número igual de aniones de hidróxido y cationes de hidronio. En ácidos y bases, sin embargo, ese equilibrio se altera. Un exponente negativo sugiere una relación donde cuanto menor sea el nivel de pH, mayor será el poder de la solución probada. El término ‘potencia’ en el contexto de la escala de pH se refiere al hecho de que el valor 0 lo toman ácidos fuertes, incluso irritantes, mientras que el valor 14 se refiere a las sustancias alcalinas más fuertes.
La adición de ácido al agua.
Un cambio de pH desde un nivel neutral puede ser causado por la adición de sustancias de diferentes potencias. Por ejemplo, si agregamos uno de los ácidos más fuertes ( ácido clorhídrico, HCl ) al agua, hará que el ácido se disocie de acuerdo con la siguiente reacción:  A diferencia de la autodisociación del agua, el equilibrio de la disociación ácida se desplaza significativamente hacia la derecha. Por tanto, si dicho ácido se disuelve en agua ambientalmente inerte, aumentará la cantidad de iones hidronio presentes en el agua y, en consecuencia, aumentará su actividad molar. Por poner un ejemplo, según la reacción de disociación, el ácido clorhídrico concentrado a 1 mol/dm 3 introduce en la solución iones hidronio concentrados a 1 mol/dm 3 . El nivel de pH para una solución de ácido clorhídrico de este tipo se puede calcular con base en la siguiente fórmula:
A diferencia de la autodisociación del agua, el equilibrio de la disociación ácida se desplaza significativamente hacia la derecha. Por tanto, si dicho ácido se disuelve en agua ambientalmente inerte, aumentará la cantidad de iones hidronio presentes en el agua y, en consecuencia, aumentará su actividad molar. Por poner un ejemplo, según la reacción de disociación, el ácido clorhídrico concentrado a 1 mol/dm 3 introduce en la solución iones hidronio concentrados a 1 mol/dm 3 . El nivel de pH para una solución de ácido clorhídrico de este tipo se puede calcular con base en la siguiente fórmula: 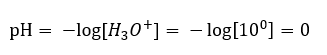
La adición de una base al agua.
En caso contrario, cuando añadimos una base fuerte al agua, la concentración de iones de hidronio disminuirá. Por ejemplo, el hidróxido de sodio concentrado a 1 mol/dm 3 tendrá, análogamente, la misma concentración pero de otros iones (iones hidróxido), según la reacción que experimente bajo la influencia del agua:  En tal caso, es posible calcular indirectamente el pH utilizando la siguiente fórmula de pOH complementaria:
En tal caso, es posible calcular indirectamente el pH utilizando la siguiente fórmula de pOH complementaria: 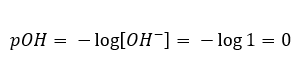 Si sabemos que:
Si sabemos que: 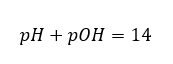 podemos calcular fácilmente que el pH de la solución de una base fuerte (NaOH) concentrada a 1 mol/dm 3 tiene un pH de 14.
podemos calcular fácilmente que el pH de la solución de una base fuerte (NaOH) concentrada a 1 mol/dm 3 tiene un pH de 14. 
¿El nivel de pH fuera de la escala?
Dado que la escala de pH se desarrolló originalmente para propósitos de soluciones diluidas, es posible que los ácidos o bases fuertes la superen, yendo por debajo de 0 o por encima de 14. Esto se debe a que la escala es inútil para altas concentraciones donde el pH ya no es logarítmico. función de los iones hidronio [H 3 O +]. Entonces usamos diferentes valores, que surgen de equilibrios constantes de la disociación de ácidos y bases.
Métodos para determinar el valor de pH de la solución.
Para determinar empíricamente el pH de un ambiente, utilizamos los llamados indicadores ácido-base. En la práctica, son sustancias que cambian de color cuando se ven afectadas por diferentes condiciones de pH. Hay tres tipos de tales indicadores:
- Indicadores que cambian de color en un entorno básico, por ejemplo:
- la fenolftaleína incolora se vuelve de color frambuesa,
- la timolftaleína incolora se vuelve azul.
- Indicadores que cambian de color en un ambiente ácido, por ejemplo:
- el naranja de metilo cambia su color de naranja a rojo,
- El azul de bromotimol cambia su color de azul a amarillo.
- Indicadores universales, por ejemplo:
- El azul de bromotimol se vuelve amarillo en ácidos y azul en bases,
- lacmus se vuelve rojo en ácidos o azul en bases.
También es común remojar papeles de tornasol en una mezcla de diferentes sustancias indicadoras, lo que aumenta el rango de los niveles de pH. Además, muchos laboratorios utilizan papeles de tornasol universales listos para usar que cambian de color en el rango de rojo a verde, lo que sugiere adecuadamente el pH probado en función de una escala adjunta. Tal determinación nos permite estimar solo el valor de pH con una precisión de 0,5 unidades en la escala de pH. Un método más preciso para medir el valor del pH es la titulación ácido-base, que incluye los subtipos de alcalimetría (titulación con una solución básica estandarizada) y acidimetría (titulación con una solución ácida estandarizada). Utiliza un valorante de concentración conocida que, al reaccionar con la sustancia ensayada, varía continuamente la concentración de iones hidronio presentes en la solución. Dicha determinación puede realizarse de dos formas: visualmente, al determinar el punto final, junto con el cambio de color o con el uso de métodos instrumentales, por ejemplo, potenciometría o conductometría. Como sugiere su nombre, el uso de un medidor de pH también nos permite definir el valor de pH de la sustancia. El instrumento, que opera en base a potenciometría, tiene una celda en dos electrodos idénticos. Uno de ellos, llamado electrodo indicador, debe colocarse en la solución probada. El otro (electrodo de comparación) se coloca en la solución estándar con un valor de pH conocido. Una sustancia de uso común es la solución de cloruro de plata. Ambos electrodos están conectados con un voltímetro extremadamente sensible, que convierte continuamente la EMF (fuerza electromotriz) en un resultado particular en la escala de pH. Según la teoría de Nernst, la fuerza electromotriz (EMF) de la celda, formada por dos electrodos idénticos sumergidos en soluciones con diferentes valores de pH, es directamente proporcional al logaritmo del cociente de ambas concentraciones.
Métodos caseros para medir el valor del pH.
Resulta que hay muchos indicadores de pH naturales y el valor de pH aproximado se puede medir en el entorno doméstico. Por ejemplo, una infusión hecha de hojas de té negro se vuelve más brillante cuando se mezcla con un ácido, por ejemplo, jugo de limón. Por el contrario, se oscurece bajo la influencia de bases como una solución de bicarbonato de sodio. El jugo de col morada cambia su color de violeta a rojo cuando se somete a un ácido, o a azul cuando se mezcla con una base.

