Alkanlar kimyasal yapı bakımından hidrokarbonlar grubuna aittir. Bu bileşikler sadece iki tür atom içerir: karbon ve hidrojen. Hidrojen atomları ile bağlantılı temel karbon çerçevesinden oluşurlar. Alkanların sadece tekli bağları vardır, bu yüzden doymuş hidrokarbonlar olarak adlandırılırlar.

Homolog seri
Yapılarında artan miktarda hidrojen atomları tarafından düzenlenen alkan temsilcileri, homolog bir dizi oluşturur. Bir karbon atomu içeren metan ile başlar ve dokuz karbon atomu içeren dekan ile biter. Alkanların adları, yapılarında bulunan karbon atomlarının miktarından gelir ve heptan, nonan, vb. gibi karakteristik -an ekinin yanı sıra Yunan veya Latin rakamlarıyla tanımlanır. Alkanlar için genel formül aşağıdaki gibidir: burada ‘n’ zincirde bulunan karbon (C) sayısını ve ‘H’ hidrojen atomlarını temsil eder.
| Zincirde bulunan karbon atomlarının sayısı | alkan formülü | alkan adı |
| 1 | kanal 4 | Metan |
| 2 | C2H6 _ | Etan |
| 3 | C3H8 _ | Propan |
| 4 | C4H10 _ | Bütan |
| 5 | C5H12 _ | pentan |
| 6 | C6H14 _ | heksan |
| 7 | C 7 H 16 | heptan |
| 8 | C8H18 _ | Oktan |
| 9 | C9H20 _ | nonan |
| 10 | C10H22 _ | Dekan |
Doymuş hidrokarbon türleri
Zincir yapısı açısından aşağıdaki alkan türlerini ayırt ederiz:
-
Doğrusal (parafin) alkanlar
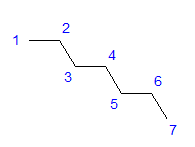 Şekil 1 Heptanın yapısal formülü Tüm karbon atomları sp3 hibritleşmesini gösterir. Bağlar arasındaki dörtgen açı nedeniyle, karbon atomlarının zikzak şeklinde bir düzenlemesi gerekir. Karbon atomları arasındaki tek bir bağ etrafında serbest dönüş mümkün olduğundan, moleküller çeşitli düzenlemeler alabilir. Yapıdaki karbon sayısı ne kadar yüksek olursa, zincir şekilleri o kadar çeşitli olabilir.
Şekil 1 Heptanın yapısal formülü Tüm karbon atomları sp3 hibritleşmesini gösterir. Bağlar arasındaki dörtgen açı nedeniyle, karbon atomlarının zikzak şeklinde bir düzenlemesi gerekir. Karbon atomları arasındaki tek bir bağ etrafında serbest dönüş mümkün olduğundan, moleküller çeşitli düzenlemeler alabilir. Yapıdaki karbon sayısı ne kadar yüksek olursa, zincir şekilleri o kadar çeşitli olabilir.
-
İzoalkanlar: dallanmış doymuş hidrokarbonlar
Dallanmış hidrokarbonların oluşumu, bir karbon atomu ile ikiden fazla diğer karbon atomu arasındaki bağlantının etkisidir. Böyle bir bağlantı noktasında bir dal oluşur. Dallanmış hidrokarbonlar doğrusal hidrokarbon izomerleridir. 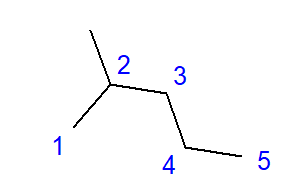 Şekil 2 2-metilpentan için yapısal formül Şekil 2’de gösterilen 2-metilpentan formülü toplam altı karbon atomuna sahiptir ve bir heksan izomeridir. ‘2-metilpentan’ adı, pentan zincirinin ikinci karbon atomunun konumunda bağlı bir metil grubuna sahip olduğu anlamına gelir. Olası yapısal izomerlerin sayısı, artan karbon sayısıyla birlikte artar. Örnek vermek gerekirse, hekzan 5 farklı izomerden oluşan bir yapıya sahip olabilir, oktan 18 ve hekzan 75’e kadar olabilir.
Şekil 2 2-metilpentan için yapısal formül Şekil 2’de gösterilen 2-metilpentan formülü toplam altı karbon atomuna sahiptir ve bir heksan izomeridir. ‘2-metilpentan’ adı, pentan zincirinin ikinci karbon atomunun konumunda bağlı bir metil grubuna sahip olduğu anlamına gelir. Olası yapısal izomerlerin sayısı, artan karbon sayısıyla birlikte artar. Örnek vermek gerekirse, hekzan 5 farklı izomerden oluşan bir yapıya sahip olabilir, oktan 18 ve hekzan 75’e kadar olabilir.
-
Siklik hidrokarbonlar: sikloalkanlar, alisiklik hidrokarbonlar
Tekrar eden –CH 2 – elementlerinden oluşan halkalar oluşturulurken zincir yapısını kapatmak mümkündür. İsimler, siklobütan veya sikloheptan gibi ‘siklo-‘ ön ekli alkanın adına dayanmaktadır. Kolaylaştırmak için normal çokgenler olarak sunulabilirler. 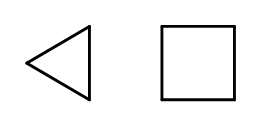 Şekil 3 Soldan: siklopropan, siklobütan İsimleri ikame edicileri içeren ikame halkalar da vardır. Bu durumda, karbon atomlarının sayısı, sübstitüentlerin konumu muhtemelen düşük olacak şekilde tasarlanır.
Şekil 3 Soldan: siklopropan, siklobütan İsimleri ikame edicileri içeren ikame halkalar da vardır. Bu durumda, karbon atomlarının sayısı, sübstitüentlerin konumu muhtemelen düşük olacak şekilde tasarlanır.
En önemli temsilciler
Metan, homolog alkan serisini başlatan, moleküler formülü CH4 olan bir bileşiktir. Karbon dört değerlidir, bu nedenle dört CH bağına sahiptir. Oda sıcaklığında kokusuz ve renksiz bir gazdır. Karbon atomu sp 3 hibridizasyonu gösterdiği için tetrahedron yapıdadır ve üretilen orbitaller dört hidrojen atomu ile birlikte eşdeğer bağlar oluşturur. Etan, moleküler formülü C2H6 olan serideki bir sonraki alkandır . H 3 C-CH 3 yarı yapısal formülüne baktığımızda, her bir karbon atomunun üç hidrojen atomu ile bağlantılı olduğunu fark edeceğiz. Tıpkı metan ve diğer düşük hidrokarbonlar gibi renksiz ve kokusuz bir gazdır. CH bağları frontal sigma sp-s bağlarıdır, karbon atomları arasındaki tekli bağ ise frontal sigma sp-sp bağıdır.
alkanların sentezi
- Alkenlerin veya alkinlerin hidrojenlenmesi

- Grignard bileşiklerinin hidrolizi
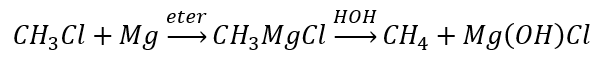
- Alkil halojenürlerin indirgenmesi
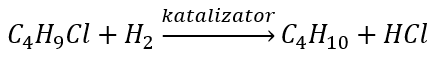
- Wurtz reaksiyonu
Aldehitlerin ve ketonların indirgenmesi
- Clemmensen azaltma
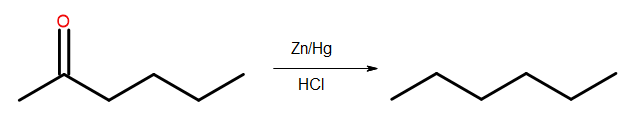 Şekil 4 Clemmensen indirgemesi diyagramı
Şekil 4 Clemmensen indirgemesi diyagramı
- Wolff-Kishner tepkisi
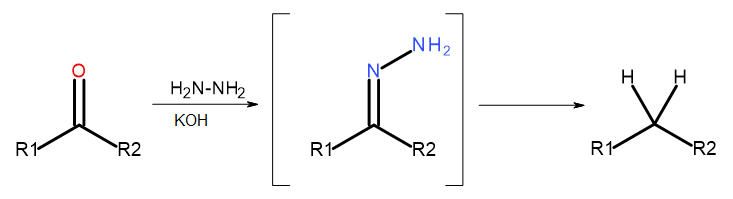 Şekil 5 Wolff-Kishner’ın Şeması
Şekil 5 Wolff-Kishner’ın Şeması
Alkanların fiziko-kimyasal özellikleri
Oda sıcaklığında Cı ila C4 arasındaki kısa zincirli alkanlar gazlardır. Diğer homologlar (pentandan başlayarak), artan kaynama noktasına sahip sıvılardır. Yapıda bulunan dallar, izomerlerin daha düşük kaynama noktasına neden olur. Yapıya başka bir -CH 2 – grubu ekleme bağımlılığı, karbon zincirinin uzunluğunun artmasıyla birlikte kaynama noktasını yaklaşık 20–30 o C yükseltir. Oktadekandan yukarı alkanların agregasyon durumu katıdır ve n-oktadekan için 28 o C’den başlayan erime noktaları vardır. Katı hidrokarbonlar arasında parafin bulunurken, daha yüksek sıvı hidrokarbonlar arasında parafin yağı bulunur. Alkan molekülleri hidrofobik yapıları nedeniyle suyla karışmazlar, suyla ıslanmazlar ve suda çözünmezler. Ancak apolar özelliklere olan yakınlıkları ile kendi içlerinde ve benzeri apolar, orta ve düşük polariteye sahip organik çözücülerde kolaylıkla çözünürler. Alkanların iki popüler alkollü çözücüde (metanol ve etanol) çözünürlüğü nispeten iyidir. Metanolde, alkanlar yalnızca belirli bir konsantrasyona kadar iyi çözünür. Bu konsantrasyonun fazla olması fazların ayrılmasına neden olur. Etanolde düşük alkanlar çok kolay çözünürken, yüksek alkanları çözmek biraz daha zordur. Daha yüksek hidrokarbonlar yanıcı maddelerdir. Gaz halindeki hidrokarbonlar ve sıvı hidrokarbon çiftleri, hava ile karıştırıldığında patlama potansiyeli olan karışımlar oluşturur. Alkanların reaktivitesi, potansiyel olarak reaktif fonksiyonel grupların olmaması nedeniyle nispeten düşüktür. Karbon atomları (CC) ile karbon ve oksijen (CH) atomları arasındaki bağlar bölünmeye karşı oldukça dirençlidir. Bu bağların enerjileri sırasıyla 88 kcal/mol ve 104 kcal/mol’dür. Sadece belirli koşullarda ani tepki verebilirler.
Alkanların reaksiyonları
- Tam yanma – karbondioksit emisyonu ile
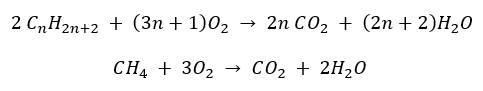
- Yarı yanma – sınırlı oksijen ve karbon monoksit emisyonu ile
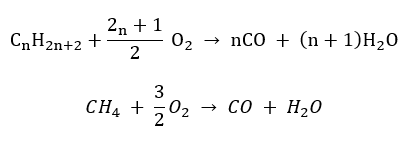
- Eksik yanma – karbon siyahı çok sınırlı miktarda oksijenle oluşur
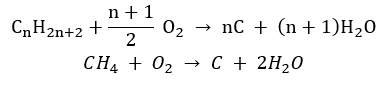
- İkame reaksiyonu (metan ile klorin ışığın katılımıyla reaksiyonu ile örneklenen radikal halojenasyon)
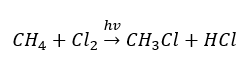
- Piroliz, alkanların çok yüksek bir sıcaklıkta daha küçük moleküllere ayrışmasıdır. Prosese bağlı olarak çatlama, hidro-çatlama veya izomerizasyon meydana gelebilir.
- Nitrik(V) asit kullanımıyla nitrasyon ve bir ürün karışımının oluşumu: çeşitli yerlerde –NO 2 sübstitüentli izomerler.
- Mersollerin ara ürünler ve mersolanların nihai ürün olduğu iki aşamalı sülfonasyon.

