Em termos de estrutura química, os alcanos pertencem ao grupo dos hidrocarbonetos. Esses compostos contêm apenas dois tipos de átomos: carbono e hidrogênio. Eles são compostos da estrutura de carbono de base ligada a átomos de hidrogênio. Os alcanos possuem apenas ligações simples, por isso são chamados de hidrocarbonetos saturados.

Série homóloga
Arranjados pela quantidade crescente de átomos de hidrogênio em sua estrutura, os representantes dos alcanos formam uma série homóloga. Começa com o metano, contendo um átomo de carbono, e termina com o decano com nove átomos de carbono. Os nomes dos alcanos vêm da quantidade de átomos de carbono que existem na estrutura e são definidos com numerais gregos ou latinos, bem como a terminação característica -ano, como com heptano, nonano, etc. A fórmula geral dos alcanos é a seguinte: , onde ‘n’ representa o número de carbono (C) presente na cadeia e ‘H’ representa os átomos de hidrogênio.
| O número de átomos de carbono presentes na cadeia | fórmula de alcano | Nome do alcano |
| 1 | CH 4 | Metano |
| 2 | C 2 H 6 | Etano |
| 3 | C 3 H 8 | Propano |
| 4 | C 4 H 10 | butano |
| 5 | C 5 H 12 | pentano |
| 6 | C 6 H 14 | hexano |
| 7 | C 7 H 16 | Heptano |
| 8 | C 8 H 18 | Octano |
| 9 | C 9 H 20 | nonano |
| 10 | C 10 H 22 | decano |
Tipos de hidrocarbonetos saturados
Em termos de estrutura de cadeia, distinguimos os seguintes tipos de alcanos:
-
Alcanos lineares (parafina)
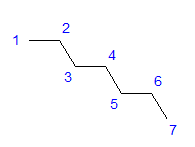 Fig. 1 Fórmula estrutural do heptano Todos os átomos de carbono mostram a hibridização sp 3 . Devido a um ângulo tetragonal entre as ligações, é necessário um arranjo em forma de zigue-zague dos átomos de carbono. As moléculas podem assumir vários arranjos, pois a rotação livre é possível em torno de uma ligação simples entre os átomos de carbono. Quanto maior o número de carbonos na estrutura, mais variadas podem ser as formas da cadeia.
Fig. 1 Fórmula estrutural do heptano Todos os átomos de carbono mostram a hibridização sp 3 . Devido a um ângulo tetragonal entre as ligações, é necessário um arranjo em forma de zigue-zague dos átomos de carbono. As moléculas podem assumir vários arranjos, pois a rotação livre é possível em torno de uma ligação simples entre os átomos de carbono. Quanto maior o número de carbonos na estrutura, mais variadas podem ser as formas da cadeia.
-
Isoalcanos: hidrocarbonetos saturados ramificados
A formação de hidrocarbonetos ramificados é o efeito da ligação entre um átomo de carbono e mais de dois outros átomos de carbono. Uma ramificação é formada no ponto de tal link. Hidrocarbonetos ramificados são isômeros de hidrocarbonetos lineares. 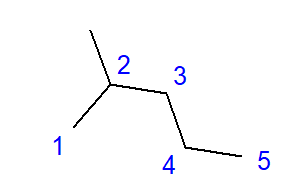 Fig. 2 Fórmula estrutural para 2-metilpentano A fórmula para 2-metilpentano mostrada na Fig. 2 tem um total de seis átomos de carbono e é um isômero hexano. O nome ‘2-metilpentano’ significa que a cadeia de pentano possui um grupo metil ligado na posição do segundo átomo de carbono. O número de possíveis isômeros estruturais cresce junto com o aumento do número de carbonos. Para dar um exemplo, o hexano pode ter uma estrutura de 5 isômeros diferentes, o octano tem 18 dessas possibilidades e o hexano até 75.
Fig. 2 Fórmula estrutural para 2-metilpentano A fórmula para 2-metilpentano mostrada na Fig. 2 tem um total de seis átomos de carbono e é um isômero hexano. O nome ‘2-metilpentano’ significa que a cadeia de pentano possui um grupo metil ligado na posição do segundo átomo de carbono. O número de possíveis isômeros estruturais cresce junto com o aumento do número de carbonos. Para dar um exemplo, o hexano pode ter uma estrutura de 5 isômeros diferentes, o octano tem 18 dessas possibilidades e o hexano até 75.
-
Hidrocarbonetos cíclicos: cicloalcanos, hidrocarbonetos alicíclicos
É possível fechar a estrutura da cadeia formando anéis compostos por elementos –CH 2 – repetidos. Os nomes são baseados no nome do alcano com o prefixo ‘ciclo-‘, como ciclobutano ou cicloheptano. Para facilitar, eles podem ser apresentados como polígonos regulares. 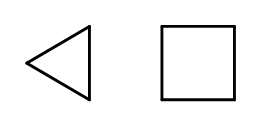 Fig. 3 A partir da esquerda: ciclopropano, ciclobutano Existem também anéis substitutos, cujos nomes incluem os substituintes. Nesse caso, os números de átomos de carbono são projetados de forma que a localização dos substituintes seja possivelmente baixa.
Fig. 3 A partir da esquerda: ciclopropano, ciclobutano Existem também anéis substitutos, cujos nomes incluem os substituintes. Nesse caso, os números de átomos de carbono são projetados de forma que a localização dos substituintes seja possivelmente baixa.
Representantes mais importantes
O metano é um composto de fórmula molecular CH 4 , iniciando a série homóloga dos alcanos. O carbono é tetravalente, por isso tem quatro ligações CH. À temperatura ambiente, é um gás inodoro e incolor. Como o átomo de carbono apresenta a hibridização sp 3 , ele é estruturado como tetraedro, e os orbitais produzidos formam ligações equivalentes juntamente com quatro átomos de hidrogênio. O etano é o próximo alcano da série, cuja fórmula molecular é C 2 H 6 . Ao olhar para a fórmula semi-estrutural H 3 C-CH 3 , notamos que cada átomo de carbono está ligado a três átomos de hidrogênio. Assim como o metano e outros hidrocarbonetos inferiores, é um gás incolor e inodoro. As ligações CH são ligações frontais sigma sp-s, enquanto uma ligação simples entre átomos de carbono é uma ligação frontal sigma sp-sp.
A síntese de alcanos
- A hidrogenação de alcenos ou alcinos

- A hidrólise de compostos de Grignard
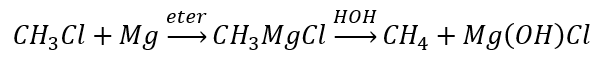
- A redução de haletos de alquila
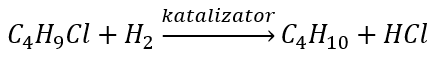
- reação de Wurtz
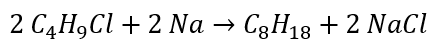
A redução de aldeídos e cetonas
- Redução de Clemmensen
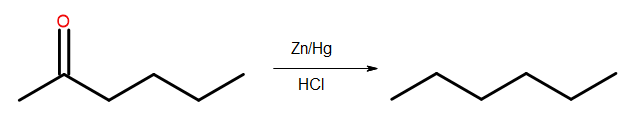 Fig. 4 Diagrama de redução de Clemmensen
Fig. 4 Diagrama de redução de Clemmensen
- Reação de Wolff-Kishner
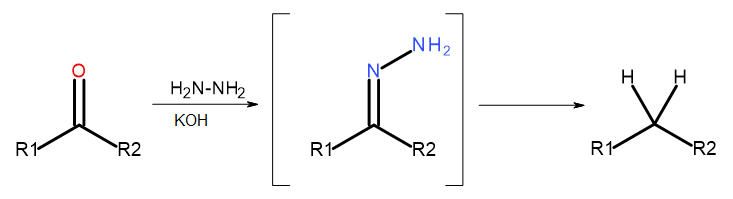 Fig. 5 Diagrama de Wolff-Kishner
Fig. 5 Diagrama de Wolff-Kishner
PROPRIEDADES FÍSICO-QUÍMICAS DOS ALCANOS
Alcanos de cadeia curta de C 1 a C 4 à temperatura ambiente são gases. Outros homólogos (a partir do pentano) são líquidos com ponto de ebulição crescente. As ramificações presentes na estrutura resultam em menor ponto de ebulição dos isômeros. A dependência de adicionar outro grupo –CH 2 – na estrutura aumenta o ponto de ebulição em torno de 20–30 o C mais alto, juntamente com o aumento do comprimento da cadeia de carbono. O estado de agregação dos alcanos a partir do octadecano é sólido com pontos de fusão a partir de 28 o C para o n-octadecano. Os hidrocarbonetos sólidos incluem a parafina, enquanto os hidrocarbonetos líquidos superiores incluem o óleo de parafina. Devido à sua natureza hidrofóbica, as moléculas de alcano não se misturam com a água, não são molhadas pela água e não se dissolvem na água. No entanto, com sua afinidade com características apolares, eles se dissolvem facilmente em si mesmos e em solventes orgânicos apolares, de média e baixa polaridade semelhantes. A solubilidade dos alcanos em dois solventes alcoólicos populares (metanol e etanol) é relativamente boa. No metanol, os alcanos se dissolvem bem apenas até uma concentração especificada. O excesso dessa concentração faz com que as fases se separem. No etanol, os alcanos inferiores se dissolvem com muita facilidade, enquanto é um pouco mais difícil dissolver os alcanos superiores. Hidrocarbonetos superiores são substâncias inflamáveis. Hidrocarbonetos gasosos, bem como pares de hidrocarbonetos líquidos, formam misturas com potencial de explosão quando misturados com o ar. A reatividade dos alcanos é relativamente baixa devido à falta de grupos funcionais potencialmente reativos. As ligações entre átomos de carbono (CC), bem como entre os átomos de carbono e oxigênio (CH), são altamente resistentes à clivagem. As energias dessas ligações são 88 kcal/mol e 104 kcal/mol, respectivamente. Eles podem reagir abruptamente apenas em certas condições.
As reações dos alcanos
- Combustão completa – com emissão de dióxido de carbono
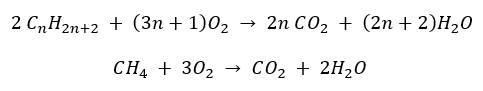
- Semi-combustão – com oxigênio limitado e emissão de monóxido de carbono
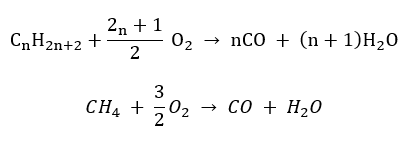
- Combustão incompleta – o negro de fumo é formado com uma quantidade muito limitada de oxigênio
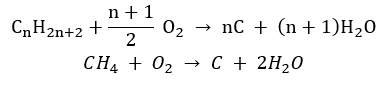
- A reação de substituição (halogenação radicalar, exemplificada pela reação do metano com o cloro com a participação da luz)
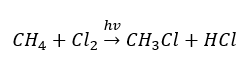
- A pirólise é a decomposição de alcanos em moléculas menores a uma temperatura muito alta. Dependendo do processo, pode ocorrer craqueamento, hidrocraqueamento ou isomerização.
- Nitração com uso de ácido nítrico(V) e formação de uma mistura de produtos: isômeros com o substituinte –NO 2 em vários locais.
- Sulfonação em dois estágios, onde os mersóis são produtos intermediários e os mersolanos são o produto final.

